
|
学习小专题 |

|
学习小专题 |
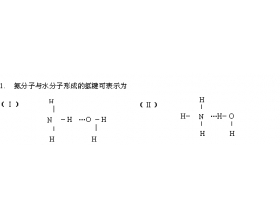 [注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9541 所属专题:氢键与熔沸点
[注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9541 所属专题:氢键与熔沸点
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于氟原子半径比氧原子小,电负性大于氧,所以 HF 分子间的 F - H … F 氢键比 H 2 O 分子间的 O — H … O 氢键要强得多,前者键能为 28KJ/mol, 后者 18.8KJ/mol 。即使在气态时, HF ...
 [注解与辨疑a] 走出理解原子结构的八个误区 作者:吴润生 来源:未知 日期:2013-04-17 15:51:50 点击:18830 所属专题:原子结构03
[注解与辨疑a] 走出理解原子结构的八个误区 作者:吴润生 来源:未知 日期:2013-04-17 15:51:50 点击:18830 所属专题:原子结构03
1. 能量最低原理就是电子首先填充到能量最低的轨道中去 能量最低原理是指基态原子核外电子的排布力求使整个原子的能量处于最低状态。不能将能量最低原理简单地理解成就是电子首先填充到能量最低的轨道中去。整个原子的能量也不能机械地看做各电子所处轨道的能量之和。因...
 [注解与辨疑a] 元素周期表中的特殊性 作者:龙立球 来源:未知 日期:2022-02-21 16:40:23 点击:11419 所属专题:元素推断 元素周期表规律
[注解与辨疑a] 元素周期表中的特殊性 作者:龙立球 来源:未知 日期:2022-02-21 16:40:23 点击:11419 所属专题:元素推断 元素周期表规律
元素周期表中的某些元素呈现的特殊性,常常作为解题的突破口,很有必要进行归纳。 1.大多数元素在自然界中有稳定的同位素,但Na、F、P、Al等元素却未被发现稳定的同位素。 2.元素周期表每个周期不一定都是从金属元素开始,如第一周期是从氢元素开始。 3.由不同种分子...
 [注解与辨疑a] 同位素简单表述 作者:陈功健 来源:未知 日期:2012-04-09 17:01:08 点击:6464 所属专题:同位素
[注解与辨疑a] 同位素简单表述 作者:陈功健 来源:未知 日期:2012-04-09 17:01:08 点击:6464 所属专题:同位素
具有相同原子序数的同一化学元素的两种或多种原子之一,在周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。同位素的表示是在该元素符号的左上角注明质量数 具有相同质子数,不同中子...
 [注解与辨疑a] 元素周期律和元素周期表的重要意义 作者:刘明 来源:未知 日期:2012-04-09 16:03:55 点击:9021 所属专题:元素周期律 元素周期表应用
[注解与辨疑a] 元素周期律和元素周期表的重要意义 作者:刘明 来源:未知 日期:2012-04-09 16:03:55 点击:9021 所属专题:元素周期律 元素周期表应用
元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面,都有重要意义。 1、在哲学方面,元素周期律提示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,从自然科学上有力地论证了事物变化的量变...
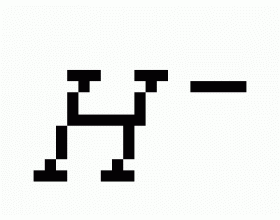 [注解与辨疑a] 元素周期表有关知识归纳、总结 作者:邬兆宇 来源:未知 日期:2014-12-18 09:43:42 点击:12367 所属专题:元素周期表
[注解与辨疑a] 元素周期表有关知识归纳、总结 作者:邬兆宇 来源:未知 日期:2014-12-18 09:43:42 点击:12367 所属专题:元素周期表
一. 主族元素的判断方法:符合下列情况的均是主族元素 1. 有1~3个电子层的元素(除去He、Ne、Ar); 2. 次外层有2个或8个电子的元素(除去惰性气体); 3. 最外层电子多于2个的元素(除去惰性气体); 4. 全部非金属元素。 二. 电子层结构相同的离子或原子(指核外电子...
 [注解与辨疑a] 原子结构方面的关系 作者:范瑞开 来源:未知 日期:2016-01-24 19:44:24 点击:9661 所属专题:原子结构03
[注解与辨疑a] 原子结构方面的关系 作者:范瑞开 来源:未知 日期:2016-01-24 19:44:24 点击:9661 所属专题:原子结构03
1. 原子的质子数、中子数、核外电子数、核电荷数的关系:①在同一微粒中:质子数=核外电子数时微粒是原子;质子数>核外电子数时微粒是阳离子;质子数<核外电子数时微粒是阴离子。②在不同的微粒中,质子数相同而中子数不同的原子必为同位素,如 、D、T。③在同一原子...
 [注解与辨疑a] 化学键方面的特殊 作者:林夕 来源:未知 日期:2016-01-24 19:45:07 点击:8758 所属专题:化学键
[注解与辨疑a] 化学键方面的特殊 作者:林夕 来源:未知 日期:2016-01-24 19:45:07 点击:8758 所属专题:化学键
1. 物质中一般存在化学键。但稀有气体中不存在化学键,只存在分子间作用力。 2. 多数气体单质为双原子分子。但稀有气体为单原子分子,臭氧为三原子分子。 3. 由非金属元素组成的化合物一般属于共价化合物。但有些是离子化合物,如NH 4 NO 3 等铵盐。 4. 由金属元素和非...
 [注解与辨疑a] 原子结构和元素性质方面特殊 作者:王欣华 来源:未知 日期:2020-11-03 08:58:24 点击:11189 所属专题:原子结构03 元素性质 原子结构03与性质
[注解与辨疑a] 原子结构和元素性质方面特殊 作者:王欣华 来源:未知 日期:2020-11-03 08:58:24 点击:11189 所属专题:原子结构03 元素性质 原子结构03与性质
1. 原子一般由质子、中子和核外电子构成。但 只由质子和电子构成。 2. 金属元素的原子最外层电子数一般小于4,而非金属元素的原子最外层电子数一般大于或等于4。但H、He、B的原子最外层电子数均小于4,其中H、B为非金属元素,He为稀有气体元素;虽然Ge、Sn、Pb、Sb、Bi...
 [注解与辨疑a] 元素核素同位素概念辨析 作者:方丽妹 来源:未知 日期:2012-03-08 18:02:27 点击:10106 所属专题:元素 核素 同位素 概念辨析
[注解与辨疑a] 元素核素同位素概念辨析 作者:方丽妹 来源:未知 日期:2012-03-08 18:02:27 点击:10106 所属专题:元素 核素 同位素 概念辨析
1.元素 概念 :元素是具有相同核电荷数(即质子数)的一类 原子 的总称。 概念剖析 :例如, (氕)、 (氘)、 (氚)、 (氢离子)都是氢元素, 和 都是氯元素。 思维点拨 :元素是宏观概念,只论种类,而不论个数。只要是质子数相同,不管它是原子还是失去或得到电子后的...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、研究历史 自然界中物质常见的存在形式有气态、液态和固态,决定物质状态的主要原...
...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长越短,键能越大,但受原子...
人教版高中化学必修第一册2019年6月第1版2024年7月第8次印刷P 10 3 讲解卤素单质与氢...
冰在0℃开始融化。这是本家都熟悉的事儿。 然而,世界上竟有热冰它在3.8℃方才融化! ...
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于...
1、为什么氧、氟没有最高正价?(朱朝宇) 氟是非金属性最强的元素,理论上没有哪种物...
1.如何理解分子间作用力的本质也是静电作用? 首先,在极性分子与极性分子之间,存在...