
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对于典型的离子晶体来说,位于晶格结点位置的微粒是正负离子,但是稳定的离子晶体一定是正负离子相互交替排列并紧密堆积在一起(核间距尽可能的小),正(负)离子要求有尽可能高的负(正)离子配位数——以形成更多的离子键。
所以,正负离子半径比会影响离子晶体的空间构型。
离子半径比与离子晶体的空间结构构型的关系为:
r +/ r- | 配位数 | 晶体空间结构类型 |
0.225 —— 0.414 | 4 | ZnS型 |
0.414 —— 0.732 | 6 | NaCl型 |
0.732 —— 1.000 | 8 | CsCl型 |
若 r + 再增大,可达到 12 配位; r + 再减小,则形成 3 配位。
当离子化合物中发生离子极化时,阴离子呈现出正负电荷重心分离而变形,看起来像被拉长,随着极化程度加大,表现为阳离子部分地钻入到阴离子的电子云中。
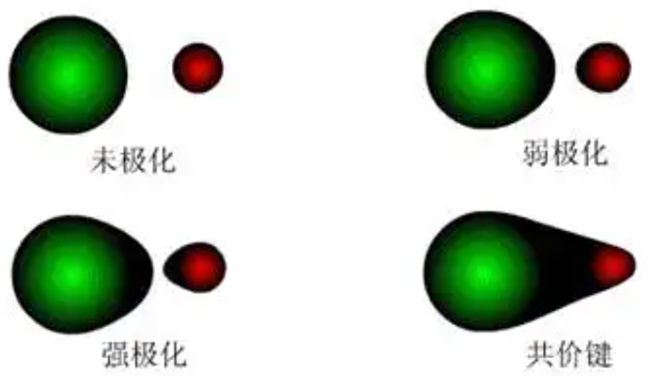
1. 离子极化引起离子晶体晶格空间构型的转变
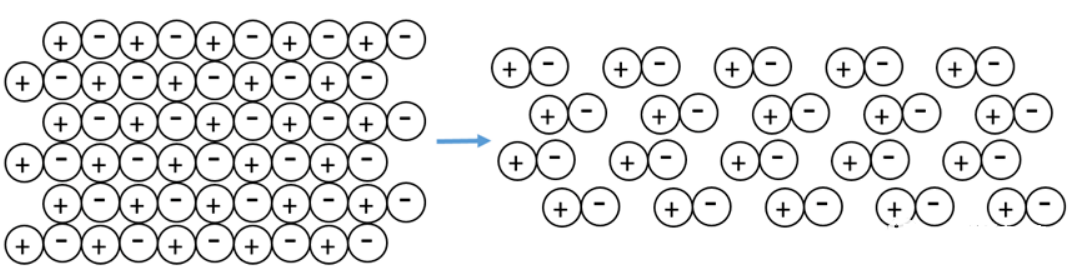
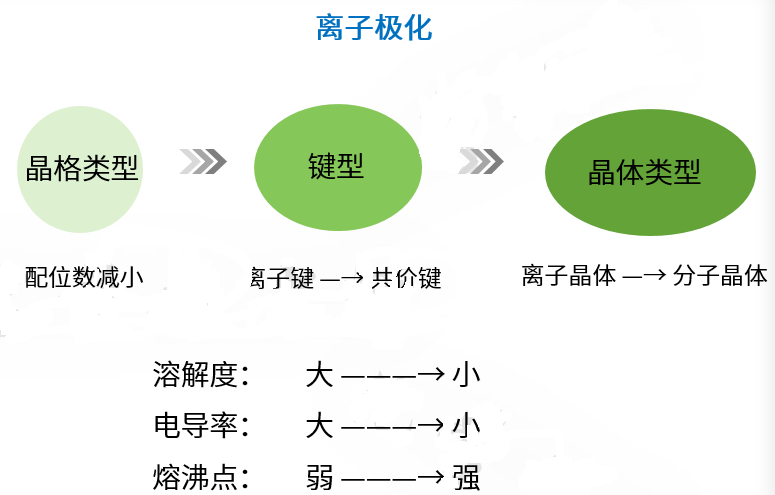
离子间的相互极化导致阳离子部分地钻入到阴离子的电子云中,那么沿着键轴方向阴离子半径增大而阳离子的半径缩小,因而使阳离子与阴离子的半径比减小,离子晶体的晶格空间构型向配位数减小的方向转化。

2. 离子极化导致离子晶体晶体类型的转变
如果离子极化程度继续加剧,相邻的正负离子之间电子云重叠形成共价键,因此离子晶体中出现离子对或分子单位,甚至形成了小分子,分子间以范德华力相结合,离子晶体向分子晶体过渡,由此会导致物质的熔点,沸点降低。
总结:


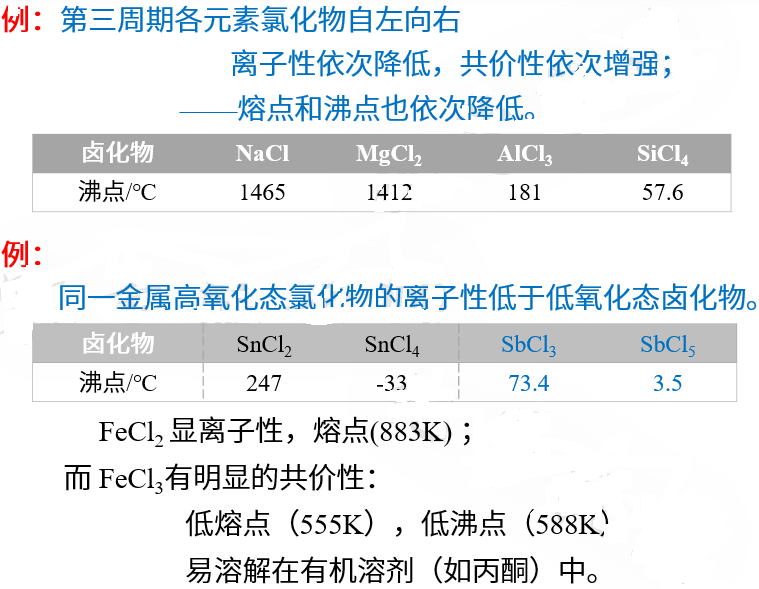
需要注意的是,
用离子极化作用来讨论物质熔沸点与利用晶格能判断离子晶体熔沸点的结果正好是相反的。
离子晶体的晶格能正比于正负离子电荷的乘积、反比于正负离子的半径,所以正负离子电荷越高半径越小,熔沸点越高。
一旦发生离子极化,正离子电荷越高半径越小(尤其是含有 d 电子的阳离子),极化程度越大,熔沸点越低。
所以区别金属化合物中发生离子极化的程度至关重要。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。离子极化与影响元素 离子极化理论是离子键理论的重要补充。 离子极化理论认为:离子化...
原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来自双方原子,这样...
p区元素化学的学习中我们常常发现,很多非金属含氧酸的游离酸不能稳定存在,但是它们...
不是的。 只能提供一对孤对电子与中心原子形成配位键,被称为单齿配体,如H 2 O分子、...
磷的含氧酸共有四种: 磷酸(H 3 PO 4 ),结构式 :三元中强酸,非氧化性的酸,难挥...
对于典型的离子晶体来说,位于晶格结点位置的微粒是正负离子,但是稳定的离子晶体一定...