
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子极化与影响元素
离子极化理论是离子键理论的重要补充。
离子极化理论认为:离子化合物中除了起主要作用的静电引力之外,诱导力起着很重要的作用。离子本身带电荷,阴、阳离子接近时,在相反电场的影响下,电子云变形,正、负电荷重心不再重合,产生诱导偶极,导致离子极化,致使物质在结构和性质上发生相应的变化。
1离子的极化作用和变形性
2离子的附加极化
3离子极化对化合物性质的影响
离子的极化作用和变形性
离子极化作用的大小决定于离子的极化力和变形性。离子使异号离子极化而变形的作用称为该离子的“极化作用”;被异号离子极化而发生离子电子云变形的性能称为该离子的“变形性”。
虽然异号离子之间都可以使对方极化,但因阳离子具有多余的正电荷,半径较小,在外壳上缺少电子,导致离子势大,因此它对相邻的阴离子起诱导作用显著;而阴离子则因半径较大,在外壳上有较多的电子容易变形,容易被诱导产生诱导偶极。所以,对阳离子来说,极化作用应占主要地位,而对阴离子来说,变形性应占主要地位。
影响离子极化作用的主要因素
(1)离子壳层的电子构型相同,半径相近,电荷高的阳离子有较强的极化作用。
例如:Al3+> Mg2+> Na+
(2)半径相近,电荷相等,对于不同电子构型的阳离子,其极化作用大小顺序如下:

(3)离子的构型相同,电荷相等,半径越小,离子的极化作用越大。
但由于阳离子半径相互差别不大,所以,阳离子的电荷数越大,极化力越大。
影响离子变形性的主要因素
(1)离子的电子层构型相同,正电荷越高的阳离子变形性越小。
例如:O2-> F-> Ne > Na+> Mg2+> Al3+> Si4+
(2)离子的电子层构型相同,半径越大,变形性越大。
例如:F-< Cl-< Br-< I-
(3)若半径相近,电荷相等,18电子层构型和不规则(9-17电子)构型的离子,其变形性大于8电子构型离子的变形性。
例如:Ag+> K+; Hg2+> Ca2+
(4)复杂阴离子的变形性通常不大,而且复杂阴离子中心原子氧化数越高,其变形性越小。
例如: ClO4-< F-< NO3-< H2O < OH-< CN-< Cl-< Br-< I-
SO42-< H2O < CO32-< O2-< S2-
从上面的影响因素看出,最容易变形的离子是体积大的阴离子(如I-、S2-等)和18电子层或不规则电子层的少电荷的阳离子(如:Ag+、Hg2+等)。最不容易变形的离子是半径小、电荷高,8电子构型的阳离子(如:Be2+、Al3+、Si4+等)。
离子的附加极化
在上面的讨论中,偏重于阳离子对阴离子的极化作用。但是,当阳离子也容易变形时,阴离子对阳离子也会产生极化。两种离子相互极化,产生附加极化效应,加大了离子间引力,因而会影响离子间引力所决定的许多化合物性质。
1. 18电子层或不规则电子层构型的阳离子容易变形,可产生附加极化作用。
2.同一族,从上到下,18电子层构型的离子附加极化作用递增。例如:在锌、镉、汞的碘化物中总极化作用依Zn2+< Cd2+< Hg2+顺序增大。
3.在18电子层构型阳离子的化合物中,阴离子变形性越大,附加极化作用越强。
离子极化对化合物性质的影响
离子极化理论对于由典型离子键向典型共价键过渡的一些过渡型化合物的性质可以作出比较好的解释。下面举例谈一下离子极化对化合物性质的影响。
影响离子晶格变形
在典型的离子化合物中,可以根据离子半径比规则确定离子晶格类型。但是,如果阴、阳离子之间有强烈的相互极化作用,晶格类型就会偏离离子半径比规则。在Ab型化合物中,离子间相互极化的结果缩短了离子间的距离,往往也减小了晶体的配位数。晶型将依下列顺序发生改变:
CsCl型>NaCl型>ZnS型>分子晶体
相互极化作用递增,晶型的配位数递减。
例如:AgCl、AgBr和AgI,按离子半径比规则计算,它们的晶体都应该属于NaCl型晶格(配位数为6)。但是, AgI却由于离子间很强的附加极化作用,促使离子强烈靠近,结果AgI以Zns型晶格存在。
影响离子晶体熔点、沸点下降
由于离子极化作用加强,化学键型发生变化,使离子键逐渐向极性共价键过渡。导致晶格能降低。例如:AgCl与NaCl同属于NaCl型晶体,但Ag离子的极化力和变形性远大于Na离子,所以,AgCl的键型为过渡型,晶格能小于NaCl的晶格能。因而AgCl的熔点(455℃)远远低于NaCl的熔点(800℃)。
化合物的颜色加深
影响化合物颜色的因素很多,其中离子极化作用是一个重大的影响。在化合物中,阴、阳离子相互极化的结果,使电子能级改变,致使激发态和基态间的能量差变小。所以,只要吸收可见光部分的能量即可引起激发,从而呈现颜色。极化作用愈强,激发态和基态能量差愈小,化合物的颜色就愈深。例如:
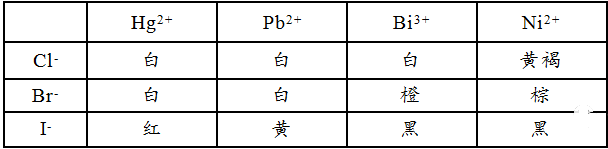
在极性溶剂中溶解度下降
物质的溶解度是一个复杂的问题,它与晶格能、水化能、键能等因素有关,但离子的极化往往起很重要的作用。一般说来,由于偶极水分子的吸引,离子化合物是可溶于水的,而共价型的无机晶体却难溶于水。因为水的介电常数(约为80)大,离子化合物中阳、阴离子间的吸引力在水中可以减少80倍,容易受热运动及其它力量冲击而分离溶解。如果离子间相互极化强烈,离子间吸引力很大,甚至于键型变化,由离子键向共价键过渡,无疑会增加溶解的难度。因此说,随着无机物中离子间相互极化作用的增强,共价程度增强,其溶解度下降。例如:
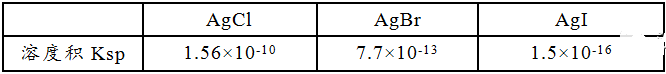
影响离子化合物热稳定性下降
在离子化合物中,如果阳离子极化力强,阴离子变形性大,受热时则因相互作用强烈,阴离子的价电子振动剧烈,可越过阳离子外壳电子斥力进入阳离子的原子轨道,为阳离子所有,从而使化合物分解。
在二元化合物中,对于同一阴离子,若阳离子极化力越大,则化合物越不稳定。例如,KBr的稳定性远远大于AgBr的稳定性。对于同一阳离子来说,阴离子的变形性越大,电子越易靠拢阳离子上,化合物就越不稳定,越容易分解。例如:
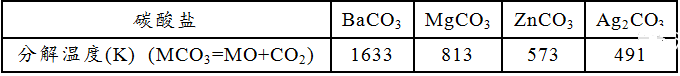
在含氧酸中,阳离子极化力大的盐,则由于阳离子的反极化作用强,对相邻氧原子的电子云争夺力强,受热时容易形成金属氧化物使盐分解。例如:
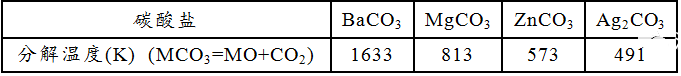
含氧酸与其含氧酸盐相比较,含氧酸的热稳定性比其盐小得多。
对盐的水解性的影响
盐类水解是指盐类溶于水后,阳离子或阴离子和水分子间相互作用,生成弱电解质(弱酸、弱碱、碱式盐或氧基盐等)的过程。水解作用的强弱与阳离子及阴离子对水分子所具有的电场力大小有关。若离子的电场力强,对水分子的极化作用大,能够引起水分子变形产生较大偶极,甚至断裂成两部分:OH-、H+,与离子电荷相反的一部分组合在一起,形成水解产物。对于盐来说,不一定阴、阳离子同时发生水解。若盐的阴离子水解,则生产弱酸,其酸的强度越弱,盐的水解度越大。若阳离子水解,其水解能力与离子极化力成正比。离子的极化力越大,离子的水解度越大(PKh值越小)。
增强导电率和金属性
有的情况下,阴离子被阳离子极化后,使自由电子脱离了阴离子,这样就使离子晶格向金属晶格过渡,电导率因而增加,金属性也相应增强,硫化物的不透明性,金属光泽等都与此有关。如FeS、CoS、NiS等化合物,特别是它们的矿石均有金属光泽。
离子极化理论在无机化学中,有一定的实用价值,能够粗略地解释一些简单无机物的性质,目前成为无机化学、结晶化学等教科书中的一个基本原理。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一般来说,同主族元素形成的R-R键键能从上至下,键长逐渐增大,键能逐渐降低。所以选...
离子极化与影响元素 离子极化理论是离子键理论的重要补充。 离子极化理论认为:离子化...
原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来自双方原子,这样...
p区元素化学的学习中我们常常发现,很多非金属含氧酸的游离酸不能稳定存在,但是它们...
不是的。 只能提供一对孤对电子与中心原子形成配位键,被称为单齿配体,如H 2 O分子、...
磷的含氧酸共有四种: 磷酸(H 3 PO 4 ),结构式 :三元中强酸,非氧化性的酸,难挥...