
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电离平衡常数也叫电离常数,常用来描述弱电解质的电离能力,一定温度下,K值大,电离程度大,对应的弱酸(碱)的酸(碱)性相对强。在高中化学教学中,电离常数往往会体现出多面性,只要我们稍加运用,教学中的一些疑难问题就会迎刃而解。
―、解惑一:越稀越电离
在学习电离平衡时,有一个很重要的规律:稀释定律——越稀越电离,即加水稀释,浓度变小,平衡右移, 电离程度增大,但溶液中的离子浓度减小;反之补加溶 质,浓度增大,平衡右移,但其电离程度会减小。学生的疑惑就在于“增大浓度,平衡右移,电离程度怎么会减小呢?”
以一元弱酸HM为例,做如下推导:

对于同一弱电解质来说,只要温度恒定,Ka就是一 定值。Ka一定时,c减小,α(电离程度)增大;c增大,α则减小。借助于数学推导,简单易懂地解释了弱电解质的稀释定律,使学生更容易理解其本质。
同时若c为定值,α随Ka的增大而增大,说明浓度相同条件下的大小反映了不同弱电解质的电离程度 的大小,或者说酸(碱)性的相对强弱。
二、解惑二:越弱越水解
苏教版《化学反应原理》82面有“在盐类水解的过程中,如果生成的弱电解质越难电离,则生成弱电解质的倾向越大,盐水解的程度就越大,溶液中c(H+)和 c( OH-)的差别就越大”,这句话就是对“越弱越水解” 的解释。以NaA代表一元弱酸强碱盐,其水溶液中存在的平衡有:

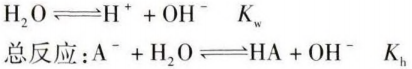
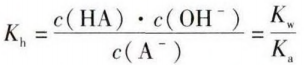
这里引入一种特殊的平衡常数─水解常数Kh,水解常数Kh只受温度的影响,用于衡量水解平衡进行的趋势,Kh大, 水解程度相对就大。温度一定时,弱酸强碱盐中,弱酸 阴离子水解生成的弱酸酸性弱(即酸对应的Ka小),则 Kh大,此盐的水解程度就大,那么对应的碱性就强。反之亦然。
例如,相同条件、相同物质的量浓度的下列几种溶 液CH3COONa、Na2CO3、NaHCO3、NaClO、NaCN,因 Ka( HCO3-) <Ka(HCN ) < Ka(HClO) < Ka( H2CO3) < Ka(CH3COOH),再根据Kh与Ka成反比的关系,得出: pH ( Na2CO3) > pH ( NaCN ) > pH ( NaClO ) > pH( NaHCO3) > pH(CH3COONa)。
由此,只要教师能将Ka与Kh有机结合起来,并完整地推导出它们成反比的关系,这样水解程度的大小与弱 酸(碱)的关系就一目了然;此时,学生弄懂的不仅仅是 “越弱越水解”这句话的涵义,更重要的是开阔了他们的思路,启迪了他们的思维。
三、解惑三:多元弱酸酸式盐溶液的酸碱性
多元弱酸酸式盐在水溶液中的情况比较复杂,会存 在多个平衡,其弱酸酸式酸根阴离子有产生H+的电离平衡,也有水解产生OH-的水解平衡,哪个平衡的程度相对大,就决定着该盐溶液的酸碱性。有学生就提出疑问:其弱酸酸式酸根阴离子的电离程度和水解程度的相对大小又如何界定呢?
以NaHCO3水溶液为例:
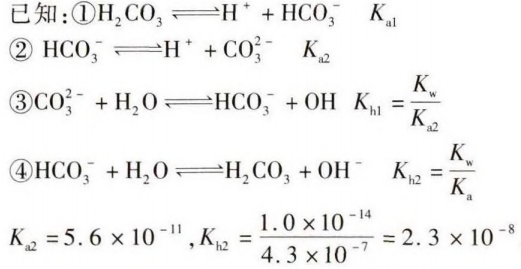
因Kh2>Ka2,所以HCO3-的水解大于电离,溶液显碱性,实验检测结果一致。
只要我们巧妙地应用电离常数和水解平衡常数,就 很容易判断出多元弱酸酸式盐溶液的酸碱性。一般 NaHCO3、NaHS、Na2HPO4的水溶液显碱性,NaHSO4、 NaHSO3、NaH2PO4的水溶液显酸性。
四、解惑四:弱酸弱碱盐溶液的水解
根据前面的分析,要正确判断一元弱酸弱碱盐溶液 的酸碱性,只需比较生成盐的酸(Ka)、碱(Kh)的电离常 数的相对大小,电离常数越小对应离子的水解程度越 大。如CH3COONH4溶液显中性,是因为代表CH3COO- 水解的Ka(CH3COOH)与代表NH4+水解的Kb(NH3·H2O)近似相等,即两者水解程度相当;NH4NO2溶液显酸性,是 因为代表NO2-水解的Ka(HNO2)大于代表NH4+水解的 Kb(NH3·H2O),即NH4+的水解程度大。对于二元或多元弱 酸弱碱盐溶液酸碱性的判断,会稍复杂一些。如 (NH4)2SO3溶液,因SO32-的水解是分两步进行,其中一 级水解SO32-+H2O HSO3-+OH-占主要因素,所以 要选用电离常数Ka(HsO3-)与Kb(NH3·H2O)进行比较,正好后者较大,故(NH4)2SO3溶液显碱性。由此,如果是一 元弱酸弱碱盐,其酸碱性往往用弱酸和弱碱电离常数的 相对大小来判断;如果是多元弱酸弱碱盐则需分清楚与 Kb比较时到底是选用Ka1、Ka2还是Ka3,只有这样,才能正 确地判断出溶液的酸碱性。
HSO3-+OH-占主要因素,所以 要选用电离常数Ka(HsO3-)与Kb(NH3·H2O)进行比较,正好后者较大,故(NH4)2SO3溶液显碱性。由此,如果是一 元弱酸弱碱盐,其酸碱性往往用弱酸和弱碱电离常数的 相对大小来判断;如果是多元弱酸弱碱盐则需分清楚与 Kb比较时到底是选用Ka1、Ka2还是Ka3,只有这样,才能正 确地判断出溶液的酸碱性。
还有一类多元弱酸弱碱的酸式盐,如NH4HCO3,、 NH4HSO3、NH4HS,它们的情况又要复杂一些。在 NH4HCO3溶液中,HCO3-的水解大于其电离,所以忽略 HCO3-的电离,只需比较代表HCO3-水解的Ka(H2CO3) 与代表NH4+水解的Kb(NH3·H2O),因后者大故显碱性。同理, 在NH4HSO3溶液中,HSO3-的电离大于其水解,所以忽略 HSO3-的水解,只需比较代表HSO3-电离的Ka(HSO3-)与 代表NH4+水解的Kb(NH3·H2O),因前者大故显酸性。
弱酸弱碱盐中,因弱酸阴离子与弱碱阳离子在水解 时会相互促进,因而其弱离子的水解程度一般比单一的 弱酸强碱盐或强酸弱碱盐中对应弱离子的水解程度要 大,两相促进的结果可能是达到一个最终的新平衡,也 可能是彻底水解,即发生了双水解。在这一点上,学生 也通常很迷糊:既然都是相互促进的水解,为什么水解 的结果却不一样呢?
以Al3+与CO32-的水解为例分析,一方面 Ka(HCO3-)很小,属于极弱酸,那么CO32-的水解程度就很大;另一方面,Al3+水解产生的Al(OH)3的溶度积很小,这样Al(OH)3就很容易脱离溶液而以沉淀形式析 出;Al3+的减少又促使CO32-水解,最终以CO2气体形式 从溶液中逸出;两相促进的结果是溶液中的Al3+和 CO32-的浓度都大幅减小,直至彻底水解转化为Al(OH)3 沉淀和CO2气体,也就是发生了双水解。再以NH4+与 CO32-的水解为例分析,一方面CO32-水解,水解程度仍然很大,其水解产物主要为HCO3-;另一方面NH4+的水解程度比CO32-稍小,其水解产物主要为NH3• H2O并 留在溶液中;两者的水解产物都没有脱离溶液而是留在溶液中,因此NH4+与CO32-的浓度没有明显减小,所以 两相促进的结果是重新建立新的平衡体系,而不是双水 解。所以,弱酸阴离子与弱碱阳离子之间能否发生双水 解,由离子的水解程度大小(电离常数越小,水解程度越大)和水解产物有无脱离溶液两方面共同决定。
五、解惑五:某些特殊的化学反应
在《化学1》中,明确说明SO2尾气可以用Na2CO3溶液吸收,其原理理解为H2SO3是中强酸,H2CO3是弱 酸,根据强酸制弱酸的原理,发生了这样一个反应 Na2CO3+SO2=Na2SO3 +CO2。但通过分析电离常数,发 现Ka( H2SO3) >Ka(H2CO3)>Ka(HSO3-) > Ka(HCO3-) ,所以,SO2与Na2CO3溶液的反应应分三种情况讨论:
①若物质的量之比1: 1 :
Na2CO3+SO2+H2O = NaHSO3+NaHCO3。
②若SO2过量,可以分两步考虑:
Na2CO3 + SO2+H2O = NaHSO3 + NaHCO3, NaHCO3 + SO2 + H2O= NaHSO3 +CO2+H2O
总反应:Na2CO3+2SO2+2H2O =2NaHSO3+CO2 + H2O
因Ka( HSO3-) >Ka(HCO3-),所以第一步生成的 NaHCO3可以与过量的SO2继续反应,但在整个反应过程中,只有NaHSO3的生成,没有Na2SO3的生成。
③若SO2少量,也分两步考虑:
Na2CO3 +SO2+H2O=NaHSO3+NaHCO3, Na2CO3+NaHSO3 = NaHCO3 + Na2SO3
总反应:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3
因Ka(HSO3-) >Ka((HCO3-),所以过量的Na2CO3与 生成的NaHSO3,可以发生第二步反应。
类似的道理,由于Ka( H2CO3) > Ka(HClO) > Ka(HCO3-),当NaClO溶液中通CO2气体时,无论CO2气体是过量还是少量,其反应方程式都应该是NaClO + CO2+H2O= HClO + NaHCO3,即整个反应过程中没有 Na2CO3的生成。
六、解惑六:反常运用
某学生想要在家中鉴别食用盐和工业盐,现在他家中只有醋酸,请问能否成功?通过查找资料发现Ka(HNO2) =4.6×10-4,Ka(CH3COOH) = 1. 76 ×10-5, 马上判断出该学生一定能成功鉴别出食用盐和工业盐。虽然亚硝酸的酸性比醋酸的酸性强,但差异不大,同时亚硝酸还不稳定,易分解产生NO、NO2,所以只要将浓醋酸滴在工业盐中,就能生成亚硝酸,加上亚硝酸易分解, 马上就能看到红棕色气体生成。
由此,在化学教学中,只要我们灵活巧妙地运用电离常数,很多化学问题都可以化繁为简、化难为易;这样化学的学习会变得更加轻松,化学课堂会变得更加高效,学生思维也会变得更加严谨。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由...