
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
当外界条件发生改变了导致化学平衡移动时,平衡体系的哪些量会发生改变?这是化学平衡部分最重要的考点之一,也是同学们容易出错的问题。下面就此进行分析,以澄清大家的一些模糊认识。
一、化学平衡中的常见量变规律
1.基本平衡量的变化规律
(1)化学平衡发生移动,一般会造成化学反应速 率、物质的平衡浓度和百分含量等都发生变化,但速率、平衡浓度变了,并不意味着平衡一定发生移动。因此,平衡移动与否应该看物质的百分含量是否改变。
(2)化学平衡向右移动,生成物的物质的量必定增加。
(3)物质的量浓度既与物质的量有关,也与体积有关。因此,只有定容时,平衡向右移动,生成物的浓度才增加。
(4)物质的百分含量既与本身物质的量(或气体体积)有关,也与总的物质的量(或气体总体积)有关。因此,只有不改变体系总质量时,平衡右移,生成物的百分含量才会增加,即此时物质的量、浓度、产率和百分含量才会有一 致的关系。
(5)在反应混合物总质量不变的前提下(如压强或温度的变化使化学平衡移动时),化学平衡总是各向着平衡混合物某组成成分百分含量增大的方向移动。百分含 量越大,平衡移动的程度越大。
(6)一个具体反应的平衡常数只与温度有关,温度不变时,平衡常数K 不发生变化。
2.转化率
对于可逆反应aA(g)+bB(g) cC(g)+dD(g):
cC(g)+dD(g):
(1)不改变反应物的用量而改变温度或压强,平衡向正反应方向移动时,各反应物的转化率增大;反之,则减小。
(2)投料比等于气态反应物的化学计量数之比时,各反应物的转化率相同。
(3)投入反应物的物质的量相同时,各反应物的转化率之比等于化学计量数之比。
(4)反应达平衡后,增加一种气态反应物 的 量,另一反应物的转化率增大,而自身的转化率减小。
(5)恒温恒容时,同等倍数地增大(或减少)气态反应物的量,各反应物的转化率同倍数地增大、减小或 不变(由反应前后气态反应物化学计量数的大小决定)。若a+b=c+d,A、B的转化率不变;若a+b<c+d,A、B的转化率都减小(或增大);若a+b>c+d,A、B的转化率都增大(或减小)。该规律同样适合只有一 种反应物的可逆反 应 aA(g) bB(g)+cC(g)。
bB(g)+cC(g)。
(6)由于加入催化剂不能使化学平衡移动,所以不能改变反应物的转化率。
可逆反应的平衡常数和转化率都可以表示反应进行的程度,但转化率更直观一些。对同一反应,平衡常数只受温度的影响,而转化率 则 会 受 浓度、温度、压强等很多外界因素的影响。对于一 个可逆 反 应,化 学 计量数不一样时,平衡常数表达式也不一样,但对应物质的转化率相同。
3.气体的平均摩尔质量
(1)对于反应物、生成物均为气体的可逆反应,如aA(g)+bB(g) cC(g)+dD(g):当不增加或减少混合物中各组分的量,只改变温度或容器的体积等条件时,混合气体的总质量守恒。
cC(g)+dD(g):当不增加或减少混合物中各组分的量,只改变温度或容器的体积等条件时,混合气体的总质量守恒。
①若n(反应物)=n(生成物),平均摩尔质量不变;
②若n(反应物)<n(生成物),平均摩尔质量减小;
③若n(反应物)>n(生成物),平均摩尔质量增大。
(2)对于有固体或纯液体参加或生成的可逆反应,由于有固态或纯液态物质的参加或生成,化学平衡发生移动时,混合气体的总质量要随之改变,混合气体的总 物 质 的 量 也随之改变,此时混合气体的平均摩尔质量的变化情况比较复杂,需要具体讨论。
4.密度
(1)当气体的质量或体积中有一个量发生变化时,密度就会发生改变。
(2)当浓度或压强改变时,混合气体的质量或体积就会发生改变,则密度改变。
(3)对于反应物、生成物均为气 体的可逆反 应,仅是温度发生变化时,不管化学平衡如何移动,混合气体的质量和体积均不会改变,所以密度不发生变化。
5.压强
压强影响化学平衡的实质 是:改 变 反 应 物 或 生 成 物 的浓度。在一定的条件下,改变气体的物质的量n、体系的温度 T、容器的体积V 都能改变压强,但改变n和T 不能用压强影响平衡的原理来解释。
在平衡体系 中,加入一 种与平衡不相关的气体,对平衡有如下两种影响。
(1)体积不变时,虽然混合气体的总压 强 增 大,但平 衡体系中各组分的浓度不发生改变,平衡不移动。
(2)压强不变时,体积增大,各组分浓度变小,对反应前后气体的物质的量不变的可逆反应,化学平衡不移动;对反应前后气体的物质的量可变的可逆反应,化学平 衡向气 体的物质的量增大的方向移动。
如:T、p 一定,向 2SO2+O2 2SO3(g)体系中充入一定量N2,则平衡逆向移动。
2SO3(g)体系中充入一定量N2,则平衡逆向移动。
二、考查平衡量变规律的题型
1.定性判断
例1将NO2装入带活 塞的密闭容器中,当 反 应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩 气 体 体 积,平 衡 向 右 移 动,混 合 气 体 颜 色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
解析:颜色加深时平衡向左移动,所以正反应为放热反应,A 错误;B 选 项,首 先 假 设 平 衡 不 移 动,加 压 时 颜 色 加深,但平衡向右移动,使混合气体颜色在加深后的基础上变浅,但一定比原平衡的颜色深,B错误;C 选项,首先假设平衡不移动,若体积减小一半,压强为原 来 的 两 倍,但 平 衡 向右移动,使压强在原平衡两倍的基础上减小,C 正 确;D 选项,体积不变时,反应物及生成物浓度 不 变,所 以 正 逆 反 应速率均不变,平衡不移动,颜色无变化,错误。答案:C
2.定量计算
例2 在密闭容器中,将1.0molCO 与1.0molH2O混合加热 到 800℃,发 生 下 列 反 应:CO(g)+H2O(g) CO2(g)+H2(g)。一 段时间后该反应达到平 衡,测得CO的物质的量为0.5mol。则下列说法正确的是
CO2(g)+H2(g)。一 段时间后该反应达到平 衡,测得CO的物质的量为0.5mol。则下列说法正确的是
( )
A.800℃下,该反应的化学平衡常数为0.25
B.427℃时 该 反应的平衡常数为9.4,则该反应的ΔH>0
C.800℃下,若 继 续向该平衡体系中通 入1.0 mol的CO(g),则平衡时CO 物质的量分数为33.3%
D.800℃ 时,继续向该平衡体系中通 入 1.0 molH2O(g),则平衡时CO 转化率为66.7%
解析:800℃时,该反应的平衡常数为1;427℃ 时,该反应的平衡常数为9.4,说明温度降低,平衡正向移动,正反应是放热反应;根据平衡常数计算,平衡时,C项反应中消 耗CO的物质的量为2/3mol,CO的 物质的量分数 约 为44.5%;平衡时,D项反应中消 耗CO的物质的量为2/3mol,CO转化率约为66.7%。答案:D
3.综合应用
例3 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知 CO(g)+H2O(g) H2(g)+CO2(g)的 平 衡 常数随温度的变化如下表:
H2(g)+CO2(g)的 平 衡 常数随温度的变化如下表:
温度 | 400 | 500 | 830 | 1 000 |
平衡常数 | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应 是 (填 “放 热”或 “吸热”)反应。
(2)某温度下,上述反应达到平衡 后,保 持容器体积不变,升高温度,正反应速率 (填“增 大”“减 小”或“不变”)容器内混合气体的压强 (填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进 行的有 (填字母)。
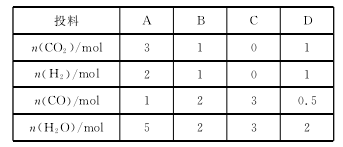
(4)在830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是 。
解析:(1)由表中数 据 可 知,升温时,化学平衡常数减小,故正反应为放热反应。
(2)升高温度时,正、逆反应速率均增大;容器体积不变的情况下,升高温度,则容器内混合气体的压强 增 大。
(3)830 ℃ 时,化学平衡常 数 为1,即 若n(CO2)×n(H2)<n(CO)×n(H2O),则反应向正反应方向进行,符合此要求的是B、C。
(4)830 ℃时,化学平衡常数为1。
CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol·L-1) 2 3 0 0
转化浓度(mol·L-1) x x x x
平衡浓度(mol·L-1) 2-x 3-x x x
K=c(H2)·c(CO2)/[c(CO)·c(H2O)]=x2/[(2-x)×(3-x)]=1,解 得x =1.2,则
CO的转化率 为1.2mol·L-1/2mol·L-1×100%=60%。
答案:(1)放热 (2)增大 增大 (3)BC(4)60%

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
一、公式提出的背景 19世纪末,化学家们逐渐意识到温度对化学反应速率具有显著影响,...
假设对于反应 a A(g) + b B(g) g G(g) + h H(g) 中各物质均为理想气体,那么则有平衡...
例:某温度、起始压强为100 kPa下,若将2mol SO 2 和1molO 2 ,通入恒容密闭容器中,...
...
什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应的最低限度的能量,称为...