
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
含氧酸盐的热稳定性,是指受热时自身 发生分解反应的性能。分解温度愈高,稳定性愈强。各种含氧酸盐受热分解的形式和产物不尽相同,中学化学教中怎样帮助学生判 断含氧酸盐的热稳定性呢?本文拟就含氧酸 盐受热分解的基本形式与一般规律,做些粗浅的探讨,仅供同志们参考。
一、含氧酸盐受热分解的三种基本形式:
1、非氧化性含氧酸的盐受热分解成两种氧化物:
例如:
CaCO3 CaO + CO2
CaO + CO2
CaSO4  CaO + SO3
CaO + SO3
2 Ca3(PO4)2  6CaO+P4O10
6CaO+P4O10
2、强氧化性含氧酸盐受热分解成多种物质:
例如:2 KNO3 2KNO2 +O2
2KNO2 +O2
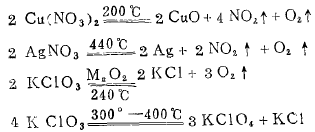
3、含氧酸的铵盐受热分解的产物比较复杂
(1)易挥发非氧化性含氧酸的铵盐受热分解。
例如:(NH4 )2CO3 2 NH3 +CO2 + H2O
2 NH3 +CO2 + H2O
(2 )难挥发性含氧酸铵盐受热分解。
例 如:(NH4)2SO4 NH3 + NH4HSO4
NH3 + NH4HSO4
NH4HSO4 NH3+H2SO4
NH3+H2SO4
(3 )氧化性含氧酸的铵盐受热分解。
例 如:
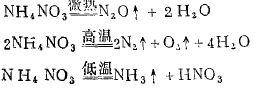
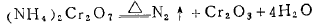
二 、含氧酸盐热稳定性的一般规律
1、同一种含氧酸盐阳离子夺取氧离子的能 力愈强,热稳定性愈弱。
例如:
(1)同种含 氧酸盐的热稳定性次序:正盐>酸式盐〉对 应的含氧酸,例如,Na2CO3分解温度(T:) 2800℃ ; NaHCO3 270°C; H2CO3室温以 下
(2)同族元素从上至下,同一含氧酸盐的热稳定性增强:例如:
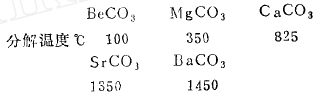
(C )不同金属的同一含氧酸的盐的热稳定性次序大致是:碱金属含氧酸盐>碱土金属含氧酸盐>副族>含氧酸铵盐,
例如:

2、对于同种阳离子的不同含氧酸P盐其热 稳定性取决于含氧段,一般含酸愈不稳定 对应的含酸盐就愈不稳定。
例如:
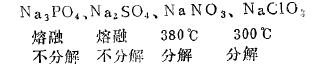
3、对于同种成酸元素,其高氧化值的含氧, 酸&比低氧化值的含氧酸盐稳定性大
例如,
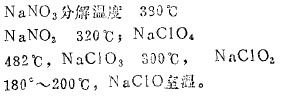
三、影响含氧酸盐热稳定性的因素:
如果说含氧酸盐的形成是由于酸性氧化物的中心元素对O2-发生极化作用的结果,那么含氧酸盐的受热分解必定与阳离子的极化力有关,即金属阳离子对O2-发生反极化的结果。 因此影响含氧酸盐热稳定性的因素可从以 下两方面考虑:
1、金属阳离子的电负性、 半径大小、电荷数和电子构型对含氧酸盐热稳定性的影响:若金属的电负性趑大,电荷 越高,半径越小,则对含氧阴离子中的外来 电子把持的趋势就越大,使含氧阴离子发生 才及化,O2-离子强烈变形。因此O2-离子与含氧阴离子的中心元素间键力被削弱,以致引起阴离子完全破裂而分解。故具有18电子外壳的余属阳离子组成的含氧酸盐比半径相 近、电荷相同的8电子外壳的金属阳离子组 成的含氧氧酸盐不稳定。
例如,SrCO3 r = 1.23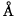 分解温变 1289 °C, PbCo3 r = 1.32
分解温变 1289 °C, PbCo3 r = 1.32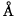 分解温度 300℃。
分解温度 300℃。
2、与含氧阴离 子对价电子的控制力,电子的对称性以及被 阳离子极化的难易程度有关:
不同中心元素 组成的含氧阴离子的稳定性是很不相同的, 对比具有相同类型化学式的硫酸盐和碳酸盐,可以看出碳酸盐比硫酸盐不稳定得多。这是 因为SO42-离子结构是各向对称的,其电子云分布也是对称的,本身不易受阳离子的极化而变形。CO32-离子的对称性仅限于平 面,且中心元素C+4的氧化值低于S+6,对O2-离子的极化性小,对电子控制能力减 弱,所以稳定性较低。
以上体会,不一定正确,希望借此抛砖 引玉,引起大家共同研讨。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1.皓矾: ZnSO 4 ·7H 2 O 2.钡餐,重晶石: BaSO 4 3.绿矾,皂矾,青矾: FeSO 4 ·7...
少量、适量、足量和过量,这几个词是化学实验和计算中的核心定量描述,区别主要在于反...
一、基础概念:从 “温度强度” 看五者的核心差异 首先需明确:这五种操作本质都是 “...
【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...