
|
学习小专题 |

|
学习小专题 |
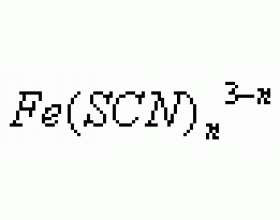 [元素化合物] 常见的物质颜色 作者:王瑜 来源:未知 日期:2012-03-27 09:08:52 点击:12225 所属专题:物质颜色
[元素化合物] 常见的物质颜色 作者:王瑜 来源:未知 日期:2012-03-27 09:08:52 点击:12225 所属专题:物质颜色
一. 常见的物质颜色 1. 红色 部分含三价铁的化合物:Fe(OH) 3 红褐色(胶体或沉淀), 血红色溶液,Fe 2 O 3 红棕色粉末,Fe 2 O 3 ·nH 2 O(铁锈)红棕色固体。 液Br 2 为深红棕色液体,Br 2 蒸气和NO 2 为红棕色气体。红磷为红棕色固体,苯酚在空气中久置变为粉红色。 2....
 [元素化合物] 条件不同 产物各异 作者:田兴虎 来源:未知 日期:2016-03-09 18:37:55 点击:18794 所属专题:条件与产物
[元素化合物] 条件不同 产物各异 作者:田兴虎 来源:未知 日期:2016-03-09 18:37:55 点击:18794 所属专题:条件与产物
在化学反应过程中,由于反应条件、反应物的物质的量不同等原因,往往使反应进程发生改变,导致反应生成物的不同。中学化学中涉及到的这类反应很多,学习、掌握和运用这些反应,不仅可以深刻理解化学反应实质,且有利于培养严谨的科学态度,使知识得以升华。 一、反应物...
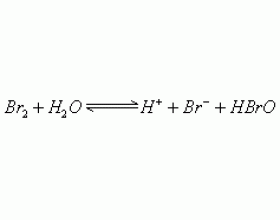 [元素化合物] 使溴水褪色的物质 作者:刘丽颖 来源:未知 日期:2013-03-28 10:27:04 点击:12984 所属专题:溴水
[元素化合物] 使溴水褪色的物质 作者:刘丽颖 来源:未知 日期:2013-03-28 10:27:04 点击:12984 所属专题:溴水
红棕色的单质 溴 溶于 水得到 的混合物俗称溴水,溶于水的 溴只有 少量与水反应。在溴水中存在如下平衡: 溴水中存在三种分子,四种离子,但由于这一反应趋势很小,因此在溴水中 溴主要 以分子形式存在。溴水的颜色由于溶有 溴 单质而呈现橙色。溴水是中学阶段常用于物...
 [元素化合物] 如何正确书写无机化学反应方程式 作者:章金莲 来源:未知 日期:2016-01-17 20:58:27 点击:7994 所属专题:化学方程式
[元素化合物] 如何正确书写无机化学反应方程式 作者:章金莲 来源:未知 日期:2016-01-17 20:58:27 点击:7994 所属专题:化学方程式
化学反应方程式是中学化学基础知识的重要组成部分,只要我们认真分析高中涉及到和高考中所考查的化学反应方程式,就会发现其中蕴涵的规律,下面就如何正确书写无机化学反应方程式谈几点做法。 一、把握高中最重要的两种反应类型 1.复分解反应(以广义酸、碱之间的中和反...
 [元素化合物] 每种酸的特点小结 作者:汪峰 来源:未知 日期:2012-03-06 15:15:00 点击:12391 所属专题:常见酸
[元素化合物] 每种酸的特点小结 作者:汪峰 来源:未知 日期:2012-03-06 15:15:00 点击:12391 所属专题:常见酸
(1)氢氟酸是一种可以腐蚀玻璃的一元弱酸(离子方程式中HF应写成分子式,氟化钠溶液显碱性,请用离子方程式表示其原因),氟化氢分子间因形成氢键而使得它的沸点在卤化氢中最高。 (2)盐酸是一种一元强酸,浓盐酸具有挥发性(瓶口有白雾)、还原性(加热时可以被二氧化锰氧化...
 [元素化合物] 高中无机反应类比失误的教训 作者:汤芹 来源:未知 日期:2012-03-05 18:14:04 点击:14176 所属专题:信息题 类比
[元素化合物] 高中无机反应类比失误的教训 作者:汤芹 来源:未知 日期:2012-03-05 18:14:04 点击:14176 所属专题:信息题 类比
1.金属铁投入硫酸铜溶液发生置换反应有铜析出:Fe+CuSO 4 ===Cu+FeSO 4 类比失误:金属钠投入硫酸铜溶液发生置换反应有铜析出:2Na+CuSO 4 ===Cu+Na 2 SO 4 失误原因: Cu 2+ 的氧化性强于H + ,但Cu 2+ 与金属钠的反应速率远小于水与金属钠的反应速率,故金属钠投入硫酸铜...
 [元素化合物] 化学反应的类比迁移18例 作者:张安荣 来源:未知 日期:2022-08-11 16:27:04 点击:17499 所属专题:化学反应 类比
[元素化合物] 化学反应的类比迁移18例 作者:张安荣 来源:未知 日期:2022-08-11 16:27:04 点击:17499 所属专题:化学反应 类比
类比思维能帮助我们认识一类本质相似的问题,找出物质变化遵循的共同规律,是利用“已知”解决“未知”的一种有效策略,达到举一反三、触类旁通、以点带面、事半功倍的学习效果。现将中学化学中可类比的部分物质性质举例如下。 1.H 2 O与NH 3 类比 电离:2H 2 O H 3 O ...
 [元素化合物] 中学化学中硫酸的作用 作者:张扬 来源:未知 日期:2016-06-01 15:32:21 点击:12611 所属专题:硫酸作用
[元素化合物] 中学化学中硫酸的作用 作者:张扬 来源:未知 日期:2016-06-01 15:32:21 点击:12611 所属专题:硫酸作用
一、制取许多气体的重要试剂 1.制H 2 (利用硫酸的酸性或H + 离子的氧化性): Zn+H 2 SO 4 (稀)==ZnSO 4 +H 2 ↑;Fe+H 2 SO 4 (稀)==FeSO 4 +H 2 ↑ 2.制SO 2 (①利用硫酸的酸性;②利用硫酸的强氧化性和酸性): ①Na 2 SO 3 +H 2 SO 4 (中等浓度)==Na 2 SO 4 +...
 [元素化合物] 中学化学中氢氧化钠的作用 作者:张楠 来源:未知 日期:2023-03-02 10:37:44 点击:26396 所属专题:氢氧化钠
[元素化合物] 中学化学中氢氧化钠的作用 作者:张楠 来源:未知 日期:2023-03-02 10:37:44 点击:26396 所属专题:氢氧化钠
氢氧化钠是学生从初中开始学习化学时就接触到的强碱性物质,它在整个高中学习中有着极其重要的作用,广泛用于各种生产生活过程和化学解题过程中。如果能熟练地运用氢氧化钠的性质,将整个高中的知识贯穿起来,使其成为联系各类物质的纽带,那么,以氢氧化钠为主体的完整...
 [注解与辨疑2] 酸碱盐知识归纳 作者:孙法军 来源:未知 日期:2016-01-17 15:01:05 点击:15277 所属专题:物质分类 酸碱盐
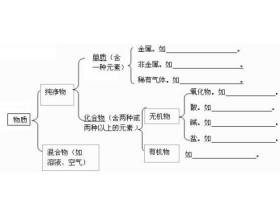
[注解与辨疑2] 酸碱盐知识归纳 作者:孙法军 来源:未知 日期:2016-01-17 15:01:05 点击:15277 所属专题:物质分类 酸碱盐
一 、酸、碱、盐的概念 物质 酸 碱 盐 概念 电离时解离出的阳离子全部是 氢离子 的化合物 电离时解离出的阴离子全部是 氢氧根 离子的化合物 由金属阳离子(或NH 4 + )和酸根阴离子组成的化合物 形式 酸 = H + + 酸根阴离子 碱 = 金属阳离子+OH - 盐=金属阳离子+酸根阴...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...