
|
学习小专题 |

|
学习小专题 |
 [探讨与扩展a] 原子的最外层电子数为什么不超过8个? 作者:章文 来源:未知 日期:2018-07-17 13:18:03 点击:5396 所属专题:核外电子排布 最外层电子
[探讨与扩展a] 原子的最外层电子数为什么不超过8个? 作者:章文 来源:未知 日期:2018-07-17 13:18:03 点击:5396 所属专题:核外电子排布 最外层电子
由于能级交错的原因,E(nd)E(n+1)s。当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,因此,最外层电子数不可能超过8个。...
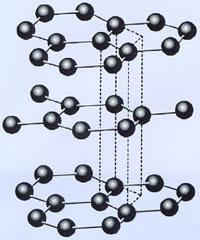 [探讨与扩展a] 氯、溴、碘的正价为什么都是奇数价? 作者:江已舒 来源:未知 日期:2017-04-17 15:11:08 点击:2277 所属专题:卤族 化合价
[探讨与扩展a] 氯、溴、碘的正价为什么都是奇数价? 作者:江已舒 来源:未知 日期:2017-04-17 15:11:08 点击:2277 所属专题:卤族 化合价
卤素原子只有一个未成对电子,当其与电负性更强的原子结合时,失去一个未成对的电子而呈+1价。当p轨道上的1对成对电子激发到空的d轨道后即进行sp 3 d杂化,这样就有三个未成对电子,成键时显+3价,以此类推,分别进行sp 3 d 2 和sp 3 d 3 杂化,成键时卤素的化合价为+5、...
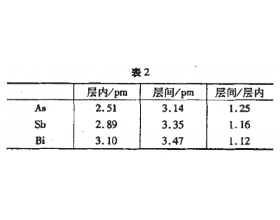 [探讨与扩展a] 浅谈化学键的过渡 作者:马文礼 来源:未知 日期:2016-05-09 15:23:39 点击:3500 所属专题:化学键
[探讨与扩展a] 浅谈化学键的过渡 作者:马文礼 来源:未知 日期:2016-05-09 15:23:39 点击:3500 所属专题:化学键
在分子或晶体中,相邻原子之间的强烈的相互作用叫做化学键。由于不同元素的原子结构各不相同,所以它们之间相互 作用的方式也不尽相同,这就形成了不同类型、不同强度的化 学键。化学键的基本类型有离子键、共价键(极性键、非极性键、 配位键)和金属键,这些化学键既有...
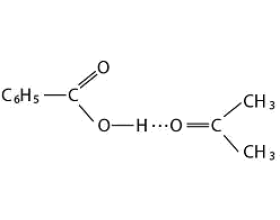 [探讨与扩展a] 氢键概述 作者:马文礼 来源:未知 日期:2016-04-19 10:58:03 点击:3887 所属专题:氢键02
[探讨与扩展a] 氢键概述 作者:马文礼 来源:未知 日期:2016-04-19 10:58:03 点击:3887 所属专题:氢键02
一、氢键的本质 氢原子似乎可以同时和两个电负性很大而原子半径较小的原子(如O、F、N等)相结合,一般表示为X—H…Y,其中H…Y的结合力就是氢键。 关于氢键的本质,直到目前为止还没有圆满的解决。一般认为X—H…Y里,X—H键基本是共价键,而H…Y则是一种强有力的有方向...
 [探讨与扩展a] 原子概念和原子结构模型的演变 作者:王绍红 来源:未知 日期:2016-04-19 09:25:32 点击:5068 所属专题:原子结构03模型
[探讨与扩展a] 原子概念和原子结构模型的演变 作者:王绍红 来源:未知 日期:2016-04-19 09:25:32 点击:5068 所属专题:原子结构03模型
人类对原子的认识史可以大致划分为5个阶段:(1)古代原子论;(2)道尔顿原子论;(3)汤姆生原子模型和卢瑟福原子模型;(4)波尔原子模型;(5)原子结构(核外电子运动)的量子力学模型。 (1)古代原子论 古希腊原子论有以下5个要点: ①所有物体都是由原子构成的。原...
 [探讨与扩展a] 四种化学半径概述 作者:吴旭东 来源:未知 日期:2016-03-17 11:13:35 点击:3418 所属专题:半径分类
[探讨与扩展a] 四种化学半径概述 作者:吴旭东 来源:未知 日期:2016-03-17 11:13:35 点击:3418 所属专题:半径分类
1.离子半径 离子半径是指离子在晶体中的“接触”半径, 即离子键的键长,是相邻正、负离子的半径和。在 离子晶体中,相邻正、负离子间存在着静电吸引力 和离子外层电子云相互作用的排斥力。当这两种 力达到平衡时,离子间保持一定的接触距离。由 原子结构可以了解到,离...
 [注解与辨疑d] 原子核外电子排布规律解析 作者:王瑜 来源:未知 日期:2021-12-17 09:37:38 点击:1245 所属专题:核外电子排布规则 核外电子分层排布
[注解与辨疑d] 原子核外电子排布规律解析 作者:王瑜 来源:未知 日期:2021-12-17 09:37:38 点击:1245 所属专题:核外电子排布规则 核外电子分层排布
...
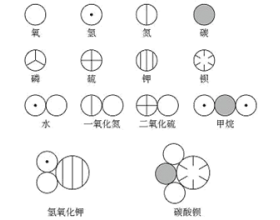
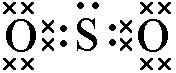 [探讨与扩展a] 二氧化硫电子式怎么写? 作者:胡长胜 来源:未知 日期:2016-01-30 11:44:58 点击:166757 所属专题:二氧化硫 电子式
[探讨与扩展a] 二氧化硫电子式怎么写? 作者:胡长胜 来源:未知 日期:2016-01-30 11:44:58 点击:166757 所属专题:二氧化硫 电子式
有不少同学把二氧化硫电子式写成下图: ( 二氧化硫错误的电子式 ) 上图所示的二氧化硫电子式是错误的!其实,二氧化硫的电子式在高中化学阶段也不要求掌握,同样属于超纲内容!! 二氧化硫有一根三中心四电子大π键,π键上的4个电子可以在整个π键中自由移动,并没有被...
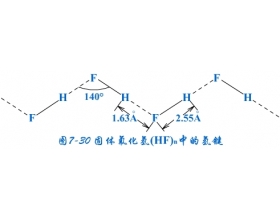 [探讨与扩展a] 氢键的形成、特点及对物质性质的影响 作者:陈万 来源:未知 日期:2016-01-24 17:54:09 点击:26111 所属专题:氢键02
[探讨与扩展a] 氢键的形成、特点及对物质性质的影响 作者:陈万 来源:未知 日期:2016-01-24 17:54:09 点击:26111 所属专题:氢键02
氢键是一种存在于分子之间也存在分子内部的作用力,它比化学键弱,又比范德华尔力强。 1、氢键的形成 在HF分子中,H和F原子以共价键结合,但因F原子的电负性大,电子云强烈偏向F原子一方,结果使H原子一端显正电性。由于H原子半径很小,又只有一个电子,当电子强烈地偏...
 [探讨与扩展a] 氢的三种同位素简介 作者:吴乾环 来源:未知 日期:2013-04-16 09:00:19 点击:25406 所属专题:同位素
[探讨与扩展a] 氢的三种同位素简介 作者:吴乾环 来源:未知 日期:2013-04-16 09:00:19 点击:25406 所属专题:同位素
氕拼音:piē。氢的同位素之一,符号 1 H(protium),质量数1,它的原子由一个质子和一个电子组成,是氢的主要成分,普通的氢中含有99.985%的氕。 氘拼音:dāo。氘为氢的一种稳定形态同位素,也被称为重氢,元素符号一般为D或 2 H。 它的原子核由一颗质子和一颗中子组成。在大自然...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【定义】又称离子有效半径,是通过实验测定的。一般认为的离子半径是:离子晶体中相邻...
关于117号元素是金属元素还是非金属元素的讨论以下几种意见: 1、非金属元素 虽然根据...
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是水素。氢是由英国化学家卡...
在我们身边的物质世界中,有气体,有液体,也有固体。他们都是由许许多多的肉眼看不见...
...
碳位于第二周期ⅣA,氮位于第二周期VA,根据同周期元素气态氢化物的稳定性从左到右依...
氯化铝(AlCl 3 )是铝的特征卤化物,它和AlBr 3 、AlI 3 均为共价化合物,而AlF 3 则是...
最新出炉的元素周期表中的第七周期中的化学元素已经被人类正式全部发现,雄心勃勃的各...