
|
学习小专题 |

|
学习小专题 |
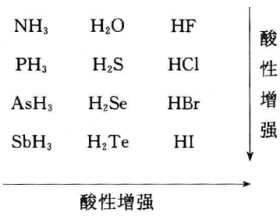 [探讨与扩展a] 无氧酸的强度有何规律?如何解释? 作者:化学自习室 来源:未知 日期:2019-11-15 08:46:29 点击:1455 所属专题:无氧酸
[探讨与扩展a] 无氧酸的强度有何规律?如何解释? 作者:化学自习室 来源:未知 日期:2019-11-15 08:46:29 点击:1455 所属专题:无氧酸
周期表上V A→VIA族元素的共价型氢化物在水或一些非水 溶剂中能够给出或结合质子而表现出酸碱性并有下述规律: 对此规律的解释大致有以下几种: (1)从H—A键的键能和键极性大小解释 上述氢化物在水溶液中释出H + 离子的难易程度与H—A之 间的键能以及这键的极性大小有关。...
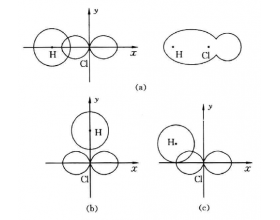 [探讨与扩展a] 共价键为什么具有方向性和饱和性? 作者:化学自习室 来源:未知 日期:2019-11-11 16:10:48 点击:11517 所属专题:共价键
[探讨与扩展a] 共价键为什么具有方向性和饱和性? 作者:化学自习室 来源:未知 日期:2019-11-11 16:10:48 点击:11517 所属专题:共价键
共价键的形成是由于成键原子的电子云相互重叠,如果电子 云重叠愈多,构成的共价键愈牢固。因此形成共价键时,两原子在可能的范围内一定采取电子云密度最大的方向相重叠。除s电 子云是球形对称的,其他如p、d、f电子云都有一定的形状和空间伸展方向。例如p电子云是哑铃形状...
 [探讨与扩展a] 离子键具有哪些特征? 作者:化学自习室 来源:未知 日期:2019-11-11 16:07:19 点击:3511 所属专题:离子键
[探讨与扩展a] 离子键具有哪些特征? 作者:化学自习室 来源:未知 日期:2019-11-11 16:07:19 点击:3511 所属专题:离子键
(1) 无方向性。 离子有单原子的,也有多原子的,例如S O 4 2 - 、 NH 4 + 等。但无论是单原子或多原子离子所带的电荷数都是属于整 个离子(原子或原子团)的,不属于个别原子的,电荷的分布是 球形对称的。因此,各个方向上都可以和电荷相反的离子相吸引, 也就是说离子键没...
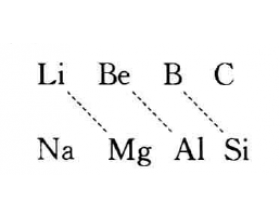 [探讨与扩展a] 什么是对角线规则? 作者:化学自习室 来源:未知 日期:2019-11-11 15:58:59 点击:14979 所属专题:对角线规则
[探讨与扩展a] 什么是对角线规则? 作者:化学自习室 来源:未知 日期:2019-11-11 15:58:59 点击:14979 所属专题:对角线规则
在周期表中某一元素的性质和它左上方或右下方的另一元素 性质的相似性,称对角线规则。这种相似性较明显地表现在Li和 Mg、Be和Al、B和Si三对元素之间。C和P、N和S、O和Cl 没有明显地存在这种关系。 (1) L i和Mg性质的相似性 ①Li和Mg在过量的氧气中燃烧,只能形成氧化物Li 2...
 [探讨与扩展a] 关于原子、离子半径比较的那些事 作者:张劲辉 来源:未知 日期:2019-07-23 16:48:53 点击:9960 所属专题:半径比较
[探讨与扩展a] 关于原子、离子半径比较的那些事 作者:张劲辉 来源:未知 日期:2019-07-23 16:48:53 点击:9960 所属专题:半径比较
一、我们的思维 我们中学老师一般会总结如下方法来比较微粒半径的大小: 三看比较原子离子半径: 1、看电子层数:电子层数越多半径越大:例如Na>Li,Na>Na + , 2、看核电荷数:电子层数相同时,核电荷数越大半径越小(“序大径...
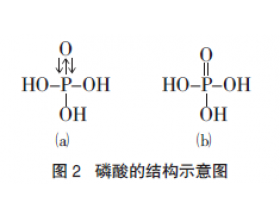 [探讨与扩展a] P元素的最高价氧化物对应水化物是H3PO4,为什么N元素却是HNO3? 作者:化学自习室 来源:未知 日期:2020-11-17 17:37:20 点击:4108 所属专题:最高价氧化物水化物
[探讨与扩展a] P元素的最高价氧化物对应水化物是H3PO4,为什么N元素却是HNO3? 作者:化学自习室 来源:未知 日期:2020-11-17 17:37:20 点击:4108 所属专题:最高价氧化物水化物
P 元素的最高价氧化物对应水化物可以是 H 3 PO 4 ,N 元素是 HNO 3 。为什么N不能 形成H 3 NO 4 ? 在 H 3 PO 4 中,P 原子采取 sp 3 杂化,三个杂化轨道与 O 原子形成三个σ 键,另一个杂化轨道被孤对电子占据,这个孤对电子进入O原子提供一个空 2p 轨道,形成配位键。同时...
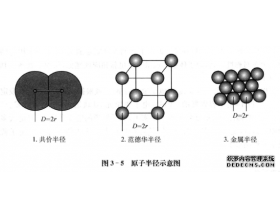 [探讨与扩展a] 什么是原子半径? 作者:吴星 来源:未知 日期:2018-08-08 15:22:43 点击:8220 所属专题:半径分类
[探讨与扩展a] 什么是原子半径? 作者:吴星 来源:未知 日期:2018-08-08 15:22:43 点击:8220 所属专题:半径分类
我们知道,原子核的周围是电子云,但原子核外的电子云并不是在离核某一特定距离就完全消失得干干净净,而是逐渐地向外蔓延,只是到离核相当远 处趋向于零,它们是没有确定的边界的。我们通常讲的原子半径是指形成共价键或金属键时,原子间接触所显示的半径。它是通过晶体分...
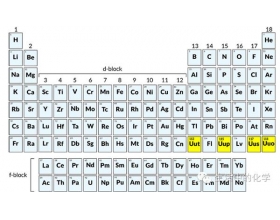 [探讨与扩展a] 为什么最近发现的4个化学元素都是人造元素? 作者:王兵 来源:未知 日期:2021-12-29 16:40:24 点击:1948 所属专题:元素发现 人造元素
[探讨与扩展a] 为什么最近发现的4个化学元素都是人造元素? 作者:王兵 来源:未知 日期:2021-12-29 16:40:24 点击:1948 所属专题:元素发现 人造元素
最新出炉的元素周期表中的第七周期中的化学元素已经被人类正式全部发现,雄心勃勃的各国科学家团队开始虎视眈眈,希望在新的第八周期上留下永久闪亮的名字。细心的读者可能已经注意到一个很奇怪的现象:这些新近发现的化学元素大部分都是人造的元素,他们都不是在地球的...
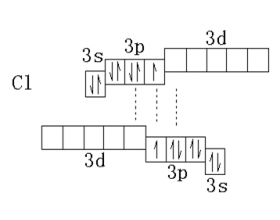 [探讨与扩展a] Cl2分子中的Cl-Cl键能为什么比F2中F-F键能高? 作者:王利平 来源:未知 日期:2017-04-18 15:46:52 点击:8976 所属专题:键能 氯气 氟气
[探讨与扩展a] Cl2分子中的Cl-Cl键能为什么比F2中F-F键能高? 作者:王利平 来源:未知 日期:2017-04-18 15:46:52 点击:8976 所属专题:键能 氯气 氟气
氯分子中Cl-Cl键的键能是239KJ·mol -1 。为什么Cl-Cl键能比F-F键能大呢?氟位于第二期,而氯位于第三周期,它具有空的3d轨道。当利用这种空的d轨道作为电子对接受体时,就能产生新的化学键。 也就是说在Cl 2 分子中既有靠未成对电子形成的共价键,又有靠孤对电子和空轨...
 [探讨与扩展a] 电价数、共价数和氧化数 作者:关平 来源:未知 日期:2017-04-18 09:46:26 点击:3887 所属专题:化合价 氧化数
[探讨与扩展a] 电价数、共价数和氧化数 作者:关平 来源:未知 日期:2017-04-18 09:46:26 点击:3887 所属专题:化合价 氧化数
化合价是元素的重要性质,它是指元素化合时彼此的数量关系,即元素化合时其原子个数是以怎样的比值进行的这一性质。电价和共价是指两类化合价。电价存在于离子化合物中。元素的一个原子形成离子化合物时所得到或失去的电子数,就称为电价数。电价数有正、负之分。 如MgO中镁...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【定义】又称离子有效半径,是通过实验测定的。一般认为的离子半径是:离子晶体中相邻...
关于117号元素是金属元素还是非金属元素的讨论以下几种意见: 1、非金属元素 虽然根据...
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是水素。氢是由英国化学家卡...
在我们身边的物质世界中,有气体,有液体,也有固体。他们都是由许许多多的肉眼看不见...
...
碳位于第二周期ⅣA,氮位于第二周期VA,根据同周期元素气态氢化物的稳定性从左到右依...
氯化铝(AlCl 3 )是铝的特征卤化物,它和AlBr 3 、AlI 3 均为共价化合物,而AlF 3 则是...
最新出炉的元素周期表中的第七周期中的化学元素已经被人类正式全部发现,雄心勃勃的各...