
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
极限概念是由于某些实际问题的精确解答而产生,我国古代数学家刘微(第三世纪)曾利用圆内接正多边形来求圆面积的方法即割圆术,就是极限思想在几何上的运用。
在化学上也经常会遇到类似的问题,用通常思想去解题难以奏效,而用极限思想去分析,大有拨开云雾见晴天的感觉。难题不再难了。
1、化学计算中类似问题
题型1
[例题1] 3g碳在足量氧气中充分燃烧,若生成一氧化碳和二氧化碳的混合气体。求参加反应氧气的质量。
解: ①假设3g碳全部趋近于生成二氧化碳,则设参加反应的氧气质量为x,
由C+O2 ![]() CO2 易解得x=8g
CO2 易解得x=8g
②假设3g碳全部趋近于生成一氧化碳,则设参加反应的氧气质量为y,
由2C+O2 ![]() 2CO 易解得y=4g
2CO 易解得y=4g
本题要生成CO2、CO混合气体,故氧气质量应在4g到8g之间。
题型2
[例题2] 5.6g不纯铁在足量稀硫酸中产生氢气0.21g,则铁中混入物质可能是( )
A、(Zn) B、(Cu) C、(Al) D、(C)
解:本题中由于碳、铜均不与酸反应而生成的H2。
(1)假设5.6g 中“混入物质”质量趋近于零,则铁的质量趋近于(但不等于,想一想为什么?)5.6g。此时,
设铁的质量为5.6g,则生成的H2的质量为x,
由Fe + H2SO4 = FeSO4 + H2↑ 易解得x=0.2g,这种情况下,生成氢气的质量将趋近于0.2克。
(2)假设铁的质量趋近于零,则混合物中铝或锌的质量趋近于5.6克。
①假设铝的质量为5.6g,则设生成的氢气的质量为y
由2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑易解得y=0.62g,这种情况下,生成氢气的质量将趋近于0.62克。
②假设锌的质量为5.6g,则设生成氢气的质量为z
由Zn + H2SO4 = ZnSO4 + H2↑
易解得z=0.17g,这种情况下,生成氢气的质量将趋近于0.17克。
由于单独5.6克铁或锌在足量稀硫酸中均不可能产生超过0.2克的氢气,而单独5.6克铝在足量稀硫酸中能产生超过0.21克的氢气 。而单独5.6克铜或碳在足量稀硫酸中均产生0克的氢气 。显而易见,5.6g不纯铁中混入物质为铜或锌或碳在足量稀硫酸中反应产生氢气的质量均只能无限趋近于0.2克而不可能达到0.21克。而5.6g不纯铁中混入物质为铝在足量稀硫酸中反应产生氢气的质量既可无限趋近于0. 2克,也可无限趋近于0.62克。显然, 这种情况下,要生成0.21克氢气才有可能性。故选(C)。
题型3
[例题3](2001上海高考题) 已知在高炉中有下列反应:Fe2O3 + CO = 2FeO + CO2 ↑,反应形成的固体混合物( Fe2O3 ,FeO )中元素铁和氧的质量比用m(Fe):m(O)表示,上述固体混合物中 m(Fe):m(O),可能是( ) (选填A、B、C多选扣分)。
A、21:9 ; B、21:75 ; C、21:6
解:因为反应形成的Fe2O3 、FeO的固体混合物中Fe2O3的铁、氧比值是21:9,当FeO质量趋近于零时,可知,混合物中m(Fe):m(O)趋近于21:9。因为FeO中的铁、氧质量比值是21:6,若混合物中Fe2O3 质量趋近于零,则混合物中m(Fe):m(O)趋近于21:6 。由极限思想可知两者混合物中的质量比值一定介于此两比值之间,故选B。
题型4
[例题4]在一个容积固定的反应器中,有一个可左右滑动的密封隔板,两侧分别进行着如图所示的可逆反应,各物质的开始反应加入量如下,A、B、C均为4摩尔,D为6摩尔,F为2.0摩尔,设E为x摩尔。当x在一定范围内变化时,均可调节反应器的温度,在两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。请填写以下空白:
(1)若x = 4.5,则在右侧反应在起始时向 (填“正反应”或“负反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于 。
(2)略(1996全国高考题)
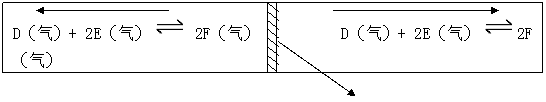
可移动隔板
解:欲使起始反应维持正反应方向进行,x 最大值意味着D或者全部趋近于完全反应
①假设D气体趋近于完全反应,
则 D(气) + 2E(气)![]() 2F(气)
2F(气)
起始量(mol) 6.5 x 2.0
变化量(mol) 6.5 13.0 13.0
平衡量(mol) 0 ( x - 13.0 )15.0
由达到平衡后各物质的量之和为12mol,可得
0 +(x -13.0)+ 15.0 = 12, 解得x = 10.0mol
因为该反应为可逆反应,达到平衡后D、E、F的量均要大于0,而E的量x - 13.0 = - 3.0(负数),故D全部反应掉显然不成立。
②若E气体趋近于完全反应掉,
则 D(气) + 2E(气)![]() 2F(气)
2F(气)
起始量(mol) 6.5 x 2.0
变化量(mol) 0.5x x x
平衡量(mol) 6.5-0.5x 0 2.0+x
由达到平衡后的各物质的量之和为12mol可知
(6.5-0.5x)+ 0 + (2.0 + x )= 12
解之得x = 7.0mol
因为该反应是可逆反应,故达到平衡时D、E、F的量均要大于0。气体E不可能全部反应掉,x = 7.0mol只是一个最大极限值,因此x < 7.0mol。
2.混合物中的有关问题
2.1根据元素的质量分数确定物质组成
[例题5]已知一氧化碳和某气体的混合物中,氧元素的质量分数为55%,则该气体是( )
A、CO2 、SO2 C、NO2 D、N2O5
解:①假设混合物另一气体质量趋近于零,则混合物中氧元素的质量分数趋近于[16/(16+12)]×100% = 57%;
②假设CO的质量趋近于零,若混合物中另一种气体是CO2 ,则混合物中氧元素的质量分数将趋近于[(16×2)/( 12+16×2)]×100% = 73%;
若混合物中另一种气体为SO2时,则混合物中氧元素的质量分数趋近于[(16×2)/( 32+16×2)]×100% = 50%;
若混合物中另一种气体为NO2,则混合物中氧元素的质量分数趋近于[(16×2)/( 14+16×2)]×100% = 70%;
若混合物中另一种气体为N2O5,则混合物中氮元素的质量分数趋近于[(16×5)/( 14×2+16×5)]×100% = 74%。
由极限思想可知55%必须在57%和另一个质量分数的区间内,因此本题中另一种物质只能是SO2,故选B。
2.2依据元素的质量比确定物质组成
[例题6]某气体可能是由一氧化碳、二氧化碳、氧气中的二种或几种组成,测得该气体中碳元素与氧元素的质量比为3:7,试推断该气体的多种可能的物质组成。
解:由题意可知,该气体是含有两种或三种气体的混合物,情况可能有多种。
①假设该气体趋于全部是一氧化碳而其它气体质量趋近于零,则该气体中碳与氧的质量比趋近于12:16 = 3:4;
②假设该气体趋于全部是二氧化碳而其它气体质量趋近于零时,则混合气体中碳与氧的质量比趋近于12:16×2 = 3:8;
③假设该气体趋于全部是氧气而CO2或CO质量趋近于零,则混合气体中碳与氧的质量比趋近于0:a(a为正数)。因为混合物是碳与氧气质量比为3:7,而①情况下混合物中碳与氧的质量比趋近于3:4,比的后项缺少3,显然,要增加氧元素的质量;②情况下混合物中碳与氧的质量比趋近于3:8,比的后项多1,显然,要增加碳元素的质量;③情况下混合物中碳与氧的质量比趋近于0:a,比的前项少3,显然,要增加碳元素的质量;综合以上分析,不难看出,该气体的组成共有三种可能性:
①一氧化碳和氧气。
②二氧化碳和一氧化碳。
③ 一氧化碳、氧气和二氧化碳。
3.化学实验中有关问题
3.1爆炸实验
爆炸实验的成功、失败等原因可用极限思想去分析。例如,氢气与空气混合气体的爆炸实验。在学生观察过教师做的演示实验之后,许多学生也想亲身体验一下。由于这里的爆炸属于“安全”爆破,我也就满足了他们的愿望,但有个条件:必须在参照课本实验后自己设计爆炸实验装置,自带用品(不允许用金属或玻璃等制品)。实验时,有的学生用氢气充填肥皂泡,有的学生用氢气充填塑料薄膜袋,有的学生则把氢气充填在塑料瓶内……设计方式多种多样,这充分展示了同学们的创造力。可点燃后的现象也是各式各样:有的爆炸意想不到的强烈,有的爆炸则很微弱,有的则始终处于安静地燃烧,有的则没有任何现象。正当同学们纳闷,怀疑自己的实验装置时,我首先肯定了他们的设计,然后用极限思想去分析:空气中含氢气在一定体积分数范围(4%~74.2%)内遇明火(或催化剂)就会发生爆炸,这个范围叫做爆炸极限.氢气的含量在爆炸极限内,当氢气与和氧气的体积之比趋近于2比1时,则爆炸就非常强烈(但十分安全)。当氢气的体积分数越来越趋近于下限(4%)或上限(74.2%)时,则爆炸就由强烈趋向于减弱。当氢气的体积不在爆炸极限内,氢气的体积分数低于下限(4%),遇空气和明火不表现为燃烧;氢气的体积分数高于上限(即74.2%),遇空气和明火能安静地燃烧。学生听后恍然大悟:原来自己的塑料薄膜袋等用品内有或没有预先装入三分之一体积的空气是导致这次实验实验效果迥异的主要原因。
以下列出一些可然性气体和易燃蒸气跟空气混合时的爆炸极限
气体(蒸汽) | 爆炸极限 | 气体(蒸汽) | 爆炸极限 |
一氧化碳 硫化氢 氨气 甲烷 乙烯 | 12.5%~74.2% 4.3%~45.5% 15.5%~27.0% 5.0%~15.0% 2.75%~28.6% | 乙醇 乙炔 苯 | 3.28%~18.95% 2.5%~80.0% 1.85%~36.5% 1.4%~7.1% |
对这些可燃性气体或蒸汽和空气的混合时点燃引起的爆炸,也同样可以用极限思想来分析。
3.2 酸的浓度对反应的影响
一定浓度的酸随着反应的不断进行,酸的浓度也自然会越来越低。当酸的浓度趋近于某一值时,该反应的速度也就趋近于零。
当铜与浓硫酸在加热条件下反应时,随着反应的进行酸的浓度会越来越小,反应就会越来越慢。当浓度趋近于某一个值时,反应也就趋近于零。故被还原的浓硫酸的量要小于所提供的浓硫酸的量的一半。浓盐酸与二氧化锰在加热条件下反应制取氯气时,随着反应的进行,浓盐酸浓度越来越小,因为二氧化锰必须在较强的酸性条件下,才可以把氯离子氧化出氯气。所以,当酸的浓度趋近于某一值时,反应速度就会趋近于零。正是由于这个原因,才会有一定量的浓盐酸与足量的二氧化锰反应时,实际生成的氯气的量比理论的量要小,同样道理,浓硝酸与铜反应时随着反应的进行,酸的浓度会越来越小。当其浓度趋近于6mol.L-1时,反应生成二氧化氮气体的速度也趋于零。浓硝酸要逐渐变成稀硝酸,硝酸的还原产物也由开始的二氧化氮变成一氧化氮,生成一氧化氮气体的反应也就开始了。
3.3对物质的“纯”与“不纯”的理解
九年义务教育三年制初级中学教科书《化学》中有这样一段话:“完全纯净的物质是没有的,通常所谓的纯净物是含有杂质很少具有一定纯度的物质”,编者意在告诉我们:人们身边的物质或多或少含有杂质。我们进行物质提纯的目的是把混合物中的杂质含量一次又一次减少,杂质含量只能无限趋近于零,但永远也不可能等于零。
[例题7]26(2)由上述实验结果评价:“用向下排空气法收集氢气,保持试管倒置移近火焰。如果只发出‘噗声’,表示收集的氢气已纯。”的说法的真正含义。(2001年全国初中生化学竞赛复赛试题)
答:这里的“氢气已纯”仅是安全意义上的纯净,即在空气氢气的体积分数大于74.2%,点燃时不会发生爆炸,而不是绝对纯净。
3.4稀释问题
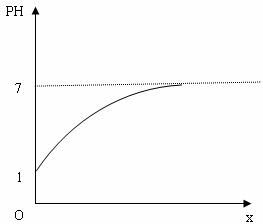
[例题8] 题目:浓度为0.10mol•L-1盐酸中不断加入水稀释,PH值将怎么样变化?并请在直角坐标系中画出溶液的酸碱度PH值随加入水的量L的变化曲线。
解:盐酸是强电解质,在水中完全电离,所以加水前盐酸提供[H+]=0.1mol•L—1通常当C酸远远大于10—6mol•L—1时,可忽略水产生的H+离子。因此,盐酸中[H+]大约等于0.10mol•L—1。当不断向盐酸中加水时,酸的的浓度会随着水不断的不断加水而变小。
设加入水的体积为xL,则有
C酸=![]()
当x→∞时C酸无限趋近于0,其电离的[H+]也无限趋近于0。此时,水的电离产生的H+离子不能忽略,为10—7。所以平衡时,盐酸水溶液中总的[H+]将由10—1mol•L—1变到无限趋近于10—7,但不能等于或大于10—7。溶液的酸碱度pH也相应由1变化到无限趋近于7。因此盐酸溶液的酸碱度PH随加入水的量x的变化曲线应为:
以上实例足以说明,极限思想在化学解题中应用具有普遍性和实用性。尤其对于多个变量的化学问题的分析、解答,往往会出现苦思冥想,一筹莫展的情况。这时,使用极限思想,会有“山穷水尽疑无路,柳暗花明又一春”的感觉。多年的化学教学让我深深体会到:教师有意识让学生掌握和运用极限思想,不仅多教给学生一种处理问题的手段,而且有助于培养学生的发散思维、收敛思维和逻辑思维能力。
[参考文献]
1、 匡奕彬、“区间答项”题常见解法,化学教学。2004第六期.
2、 丁守涛、陈军。化学复习中的对比与联想。化学教学。2004第六期。
3、 李文鼎等.九年制义务教育三年制初中化学。教师教学用书。人民教育出版社1995.11

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
热重曲线 ”类试题注重学生能力的考查 , 是近年命题的热点 ....
有些体系不只涉及一个反应,并且不同的反应之间存在着某种相...
“1”在数学里是个令人很关注的数字,它简单又特殊,透过简单...
某些反应容器中同时发生几个反应,且不同的反应之间存在着这样...
守恒思想贯穿着中学化学始终,守恒法的灵活运用能够简化解题...
论述化学反应方程式计算技巧的文字很多,但论及计算思想的不...