
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在学习中要加强对化学键中的非极性键、极性键、离子键、晶体类型及结构的认识与理解;在掌握微粒半径递变规律的基础上,分析离子晶体、原子晶体、分子晶体的熔点、沸点等物理性质的变化规律;并在认识晶体的空间结构的过程中,培养空间想象能力及思维的严密性和抽象性。
同时,关于晶体空间结构的问题,很容易与数学等学科知识结合起来,在综合题的命题方法具有广阔的空间,因此,一定要把握基础、领会实质,建立同类题的解题策略和相应的思维模式。
一、晶体
固体可以分为两种存在形式:晶体和非晶体。晶体的分布非常广泛,自然界的固体物质中,绝大多数是晶体。气体、液体和非晶体在一定条件下也可转变为晶体。
晶体是经过结晶过程而形成的具有规则的几何外形的固体。晶体中原子或分子在空间按一定规律周期性重复的排列,从而使晶体内部各个部分的宏观性质是相同的,而且具有固定的熔点和规则的几何外形。



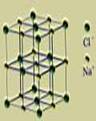
NaCl晶体结构


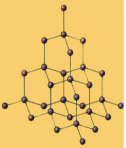

食盐晶体
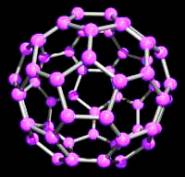

C60分子
二、晶体结构
1.几种晶体的结构、性质比较
类型 | 离子晶体 | 原子晶体 | 分子晶体 |
构成微粒 | 阴、阳离子 | 原子 | 分子 |
相互作用 | 离子键 | 共价键 | 分子间作用力 |
较大 | 很大 | 很小 | |
熔沸点 | 较高 | 很高 | 很低 |
导电性 | 溶液或熔化导电 | 一般不导电 | 不导电 |
溶解性 | 一般易溶于水 | 难溶水和其他溶剂 | |
典型实例 | NaCl、KBr等 | 金刚石、硅晶体、SiO2、SiC | 单质:H2、O2等 |
2.几种典型的晶体结构:
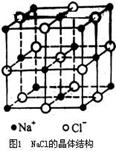
(1)NaCl晶体(如图1):每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,离子个数比为1:1。
(2)CsCl晶体(如图2):每个Cl-周围有8个Cs+,每个Cs+周围有8个Cl-;距离Cs+最近的且距离相等的Cs+有6个,距离每个Cl-最近的且距离相等的Cl-也有6个,Cs+和Cl-的个数比为1:1。
(3)金刚石(如图3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间发展,键角都是109º28',最小的碳环上有六个碳原子。

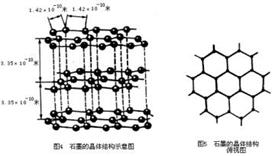
(4)石墨(如图4、5):层状结构,每一层内,碳原子以正六边形排列成平面的网状结构,每个正六边形平均拥有两个碳原子。片层间存在范德华力,是混合型晶体。熔点比金刚石高。
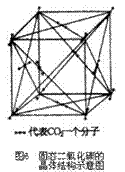
(5)干冰(如图6):分子晶体,每个CO2分子周围紧邻其他12个CO2分子。
(6)SiO2 :原子晶体,空间网状结构,Si原子构成正四面体,O原子位于两个Si原子中间。(SiO2晶体中不存在SiO2分子,只是由于Si原子和O原子个数比为1∶2,才得出二氧化硅的化学式为SiO2)


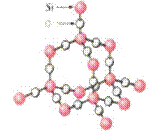
紫水晶 大水晶 二氧化硅晶体模型
3.离子晶体化学式的确定
确定离子晶体的化学式实际上是确定晶体中粒子个数比。其方法如下:
(1)处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞。
(2)处于棱上的粒子同时为4个晶胞共有,每个粒子有1/4属于该晶胞。
(3)处于面心上的粒子,同时为2个晶胞共有,每个粒子有1/2属于该晶胞。
(4)处于晶胞体心的粒子,则完全属于该晶胞。
4.根据物质的物理性质判断晶体的类型
(1)在常温下呈气态或液态的物质,其晶体应属于分子晶体(Hg除外),如H2O、H2 等。对于稀有气体,虽然构成物质的微粒为原子,但应看作单原子分子,因为微粒间的相互作用力是范德华力,而非共价键。
(2)在熔融状态下能导电的晶体(化合物)是离子晶体。如:NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。
(3)有较高的熔、沸点,硬度大,并且难溶于水的物质大多为原子晶体,如晶体硅、二氧化硅、金刚石等。
(4)易升华的物质大多为分子晶体。
三、分子间作用力和氢键
1.分子间作用力
分子间作用力又叫范德华力,是分子与分子之间微弱的相互作用,它不属于化学键范畴。分子间作用力广泛存在于分子与分子之间,由于相互作用很弱,因此只有分子与分子充分接近时,分子间才有作用力。
2.氢键
氢键是在分子间形成的,该分子中必须含有氢原子,且另一种原子吸引电子的能力很强(具体有F、O、N三种元素),只有这样才能形成氢键。常见的能形成氢键的分子主要有HF、H2O、NH3等。
氢键的实质也是静电作用,氢键的强度比分子间作用力稍强,但比化学键弱的多,它仍不属于化学键范畴。
氢键对物质熔、沸点的影响结果是使物质的熔点和沸点均升高。例如H2O和H2S的组成与结构相似,相对分子质量H2S>H2O,若仅以分子间作用力论,H2S的熔、沸点应大于H2O,可实际上H2O在常温状态下是液态,而H2S在通常状态下是气态,说明H2O的熔、沸点比H2S高,原因就是H2O分子中存在H…O键。
四、物质的熔沸点比较及规律
(1)不同类型的晶体,一般来讲,熔沸点按原子晶体>离子晶体>分子晶体。
(2)由共价键形成的原子晶体中,原子半径越小的,键长越短,键能越大,晶体的熔、沸点越高。如熔点:金刚石>石英>碳化硅>晶体硅。
(3)离子晶体比较离子键的强弱。一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。
(4)分子晶体:组成和结构相似的物质,相对分子质量越大,熔沸点越高;如Cl222。组成和结构不相似的物质,分子极性越大,其熔沸点就越高,如熔、沸点:CO>N2。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
离子液体(Ionic Liquids, ILs)是完全由离子构成、在室温或接近室...
分析硝酸铵、碳酸钠、氯化钙与氢氧化钠的溶解热,能清晰掌握...
中学化学选修3-物质结构与性质里介绍了物质结构,其中晶体结...
我们从高中化学的角度来认识一下离子液体。想象一下,如果食...
导语:想象一下,我们把原子看成是搭建豪宅(晶胞)的积木。...
在晶体分类体系中,除了分子晶体、共价晶体、金属晶体、离子...