
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机化学中的氧化反应是高考核心考点之一,其本质是有机分子失去电子(或化合价升高,如 C 元素从-3→-2→0→+2),反应能否发生、产物结构如何,关键取决于氧化剂的氧化能力、反应条件(酸 / 碱 / 温度)及有机分子的官能团类型。本文针对高三教学需求,系统梳理高考中常用的氧化剂,按 “氧化强度 + 反应类型” 分类,结合反应方程式、产物规律、考点对比,助力学生精准掌握氧化反应核心逻辑,同时为教师提供结构化教学素材。
一、氧化剂分类框架(按氧化强度与适用场景)
核心分类逻辑
根据氧化能力强弱、反应选择性(是否只氧化特定官能团),将常用氧化剂分为强氧化剂、中等强度氧化剂、弱氧化剂、特殊选择性氧化剂四大类,每类聚焦高考高频考点,避免冗余知识。
氧化剂类别 | 核心特征 | 高考出现频次 | 典型适用官能团 |
|---|---|---|---|
强氧化剂 | 氧化能力强,反应条件温和(常需酸 / 碱催化),易将官能团氧化至最高价态 | 高频(每年 2-3 题) | 烯烃、炔烃、醇、醛、苯的同系物、酚 |
中等强度氧化剂 | 氧化能力适中,选择性较强,可控制产物停留在中间价态(如醛→羧酸、醇→醛) | 中频(每 2 年 1-2 题) | 醇、醛、胺、硫醚 |
弱氧化剂 | 氧化能力弱,仅能氧化还原性极强的官能团(如醛基、酚羟基),选择性极高 | 高频(醛基检验必考点) | 醛基(-CHO)、酚羟基(-OH 直接连苯环) |
特殊选择性氧化剂 | 反应条件温和,仅氧化特定官能团(如伯醇→醛、双键顺反异构化),高考选考 | 低频(偶尔出现在有机合成题) | 伯醇、仲醇、烯烃 |
二、各类氧化剂详细解析(高考考点聚焦)
第一类:强氧化剂(高考核心重点,氧化产物多为最高价态)
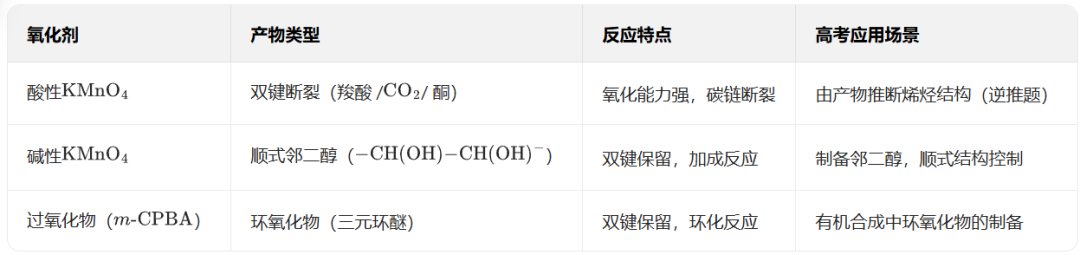
1. 酸性高锰酸钾溶液(KMnO4/H+)
核心成分:MnO4-在酸性条件下(如稀H2SO4)被还原为Mn2+(无色),氧化能力最强。
氧化原理:
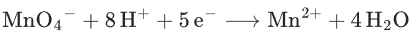
(还原半反应),有机分子失去电子被氧化。
适用官能团及产物(高考必考):

反应方程式(典型示例):
乙烯氧化:
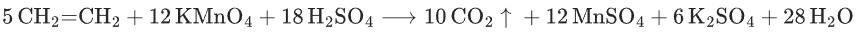
甲苯氧化:

乙醇氧化:
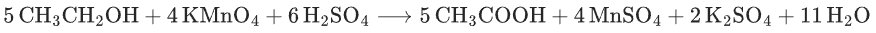
高考易错点:
苯环不能被酸性KMnO4氧化,仅侧链含α-H(与苯环直接相连的 C 上有 H)的同系物可被氧化(如甲苯、乙苯),无α-H(如叔丁基苯C6H5-C(CH3)3)不能被氧化。
烯烃氧化产物规律:双键断裂,双键碳上连 1 个 H→羧酸,连 2 个 H→CO2,连 0 个 H→酮(如(CH3)2C=CH2氧化生成丙酮和CO2)。
2. 碱性高锰酸钾溶液(KMnO4/OH-)
核心特征:氧化能力弱于酸性条件,MnO4-被还原为 MnO2(棕色沉淀),反应温和,不易断裂碳碳键。
适用场景(高考高频):
烯烃的顺式二羟基化(生成邻二醇):
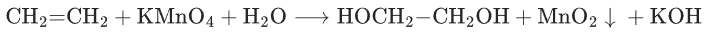
(高考常考 “烯烃→邻二醇” 的转化试剂)。
醛基氧化为羧酸盐(而非羧酸):
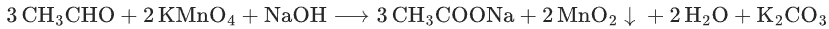
与酸性KMnO4的对比(教学重点):

3. 重铬酸钾 / 硫酸(K2Cr2O7/H+)
核心成分:
Cr2O72-在酸性条件下被还原为Cr3+(绿色),氧化能力与酸性KMnO4相近,但更温和,常用于醇的氧化(高考有机合成题高频试剂)。
适用官能团及产物:
伯醇→醛→羧酸(控制条件可停留在醛,如蒸馏分离):
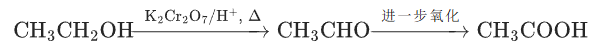
仲醇→酮(不能进一步氧化):
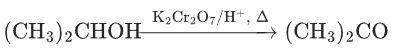
醛基→羧基:
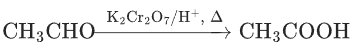
反应方程式(示例):
2 - 丙醇氧化:
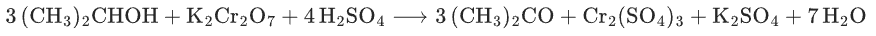
高考考点:
颜色变化:橙色Cr2O72-→绿色(Cr3+),常用于醇的检验(如酒驾检测原理:乙醇使酸性K2Cr2O7溶液变色)。
有机合成中 “醇→酮” 的首选试剂(避免过度氧化,如仲醇氧化为酮无副产物)。
4. 氧气与催化剂
核心应用:
工业氧化反应,高考常考 “催化氧化” 条件下的转化。
典型反应(高考高频):
醇的催化氧化(Cu/Ag 加热):
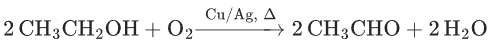
(伯醇→醛);

(仲醇→酮)
醛的催化氧化(制备羧酸):

(工业制乙酸)
苯的氧化(制备顺丁烯二酸酐):

(高考选考)
考点提示:
醇的催化氧化规律:伯醇→醛,仲醇→酮,叔醇(无α-H)不能被催化氧化(如CH3)3COOH)。
第二类:中等强度氧化剂(选择性氧化,产物为中间价态)
1. 银氨溶液(Ag(NH3)2OH,托伦试剂)
核心特征:弱氧化性,仅氧化醛基(-CHO),不氧化醇羟基、碳碳双键、三键等,选择性极高(高考醛基检验必考点)。
氧化原理:

(还原产物为银单质,形成银镜)。
适用官能团:醛基(脂肪醛、芳香醛均适用)、甲酸及甲酸酯(含潜在醛基(-CHO)。
反应方程式(示例):
乙醛与银氨溶液:

(银镜反应)
甲酸与银氨溶液:
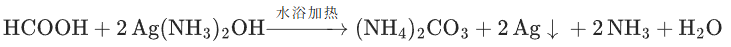
(甲酸含-CHO结构)
高考考点:
现象:产生光亮的银镜,用于醛与酮的区分(酮不反应)。
注意事项:银氨溶液需现配现用(向AgNO3溶液中逐滴加氨水至沉淀恰好溶解),水浴加热(避免沸腾),碱性环境。
易错点:酯类中仅甲酸酯能发生银镜反应,其他酯(如乙酸乙酯)不能;葡萄糖、麦芽糖(含醛基)能反应,蔗糖(无醛基)不能。
2. 新制氢氧化铜悬浊液(Cu(OH)2/NaOH),斐林试剂)
核心特征:弱氧化性,仅氧化醛基(脂肪醛),芳香醛不反应,选择性高于银氨溶液。
氧化原理:
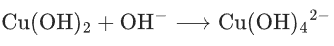
(深蓝色溶液),
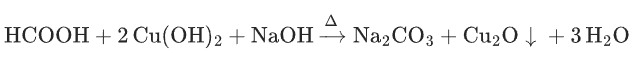
(砖红色沉淀)。
适用官能团:
脂肪醛(如乙醛、丙醛)、甲酸及甲酸酯、葡萄糖、麦芽糖。
反应方程式(示例):
乙醛与新制Cu(OH)2:
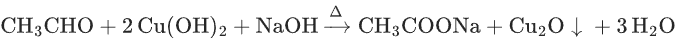
(砖红色沉淀)
甲酸与新制Cu(OH)2:
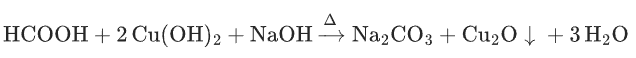
高考考点:
现象:蓝色悬浊液→砖红色沉淀,用于脂肪醛与芳香醛的区分(如苯甲醛不反应)。
制备方法:向NaOH浓溶液中滴加少量CuSO4溶液(保证NaOH过量,碱性环境)。
对比银氨溶液:银氨溶液氧化芳香醛,斐林试剂不氧化,此为高考推断题中 “区分醛的类型” 的关键。
3. 三氯化铁(FeCl3溶液)
核心特征:
弱氧化剂,主要用于酚羟基的检验(高考酚的特征反应),也可氧化某些还原性较强的有机物。
反应原理:
酚羟基与Fe3+发生显色反应(络合反应),而非氧化还原反应,但FeCl3也可氧化酚为醌类。
适用场景:
酚的检验:苯酚、邻苯二酚等含酚羟基的化合物与FeCl3溶液反应生成紫色、蓝色或绿色络合物(如苯酚→紫色)。
氧化反应:
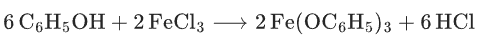
(氧化产物为酚铁络合物,显色)。
高考考点:
显色反应是酚的特征检验方法,用于区分酚与醇(醇不与FeCl3反应)。
注意:仅 “酚羟基”(直接连苯环)有效,醇羟基(如苯甲醇C6H5-CH2OH)不反应。
第三类:特殊选择性氧化剂(高考选考,有机合成题高频)
1. 二氧化锰(MnO2)
核心特征:
温和氧化剂,仅氧化烯丙醇(CH2=CH-CH2OH)、苄醇(C6H5-CH2OH)等活性醇,不氧化饱和醇,选择性极高。
适用场景:
烯丙醇→烯醛:
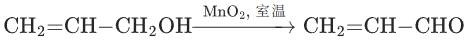
苄醇→苯甲醛:
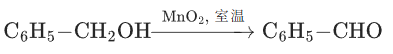
高考考点:
有机合成中 “伯醇→醛” 的温和转化(避免过度氧化为羧酸),如制备苯甲醛时,MnO2优于酸性KMnO4(后者会氧化为苯甲酸)。
2. Dess-Martin 试剂(DMP)
核心成分:
phI(OAc)2(碘苯二乙酸酯),中性温和氧化剂。
适用场景:
伯醇→醛,仲醇→酮,不氧化碳碳双键、三键、酯基等,是有机合成中 “选择性氧化” 的首选试剂(高考选考,常出现在有机合成路线题中)。
反应示例:
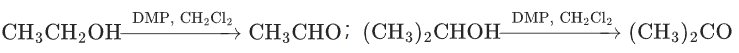
3. Swern 氧化(二甲亚砜 + 草酰氯)
核心原理:
DSO + (COCl)2→活性中间体,氧化伯醇→醛、仲醇→酮,反应条件温和(低温,-78℃),不影响其他官能团。
高考应用:
有机合成路线中 “温和氧化” 步骤的试剂选择(如复杂分子中含多个官能团时,避免氧化干扰)。
4. 过氧化物(如过氧乙酸CH3CO3H、间氯过氧苯甲酸CPBA)
核心特征:
氧化性温和,主要用于烯烃的环氧化反应(生成环氧化物),高考选考考点。
反应示例:
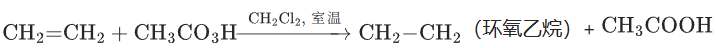
高考考点:
环氧化物是有机合成中的重要中间体,过氧化物作为环氧化试剂的选择性(仅氧化双键,不影响其他官能团)。
三、高考核心考点对比表(必备教学素材)
1. 不同氧化剂氧化醇的产物对比(高考高频推断题)

2. 醛基检验试剂对比(高考选择题 / 实验题)

3. 烯烃氧化试剂与产物对比(高考逆推题)

4. 氧化剂的选择性对比(高考有机合成题试剂选择)
四、高考真题示例与解析(对接考点)
示例 1(2023 年全国卷 Ⅰ)
某有机化合物X 的分子式为C4H10O,下列关于 X 的说法错误的是( )
A. X可能是醇或醚
B. 若 X能被酸性KMnO4溶液氧化,则 X 为伯醇或仲醇
C. 若 X能与新制Cu(OH)2反应生成砖红色沉淀,则 X 含醛基
D. 若 X为叔丁醇((CH3)3COOH),则不能被O2/Cu催化氧化
答案:C解析:
A项:C4H10O的不饱和度为 0,可能是醇(C4H9OH)或醚(C2H5OC2H5),正确;
B 项:叔醇无α-H,不能被酸性KMnO4氧化,伯醇→羧酸,仲醇→酮,正确;
C 项:新制Cu(OH)2仅氧化脂肪醛,X 为醇或醚,不含醛基,无法反应,错误;
D 项:叔丁醇无α-H,不能被O2/Cu催化氧化,正确。
示例 2(2022 年湖南卷)
化合物Y 是一种药物中间体,其合成路线如下:
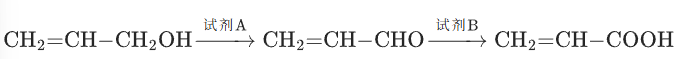
(1)试剂 A 的最佳选择是________;(2)试剂B 的最佳选择是________。
答案:(1)MnO2(或 DMP);(2)酸性KMnO4(或K2Cr2O7/H+}\))解析:
第一步:CH2=CH-CH2OH(烯丙醇,活性醇)→CH2=CH-CHO(醛),需温和氧化剂,避免氧化双键,故选择MnO2或 DMP;
第二步:CH2=CH-CHO→CH2=CH-COOH(羧酸),需强氧化剂,酸性KMnO4或K2Cr2O7/H+均可(双键在此条件下是否断裂?因双键为烯丙基型,酸性KMnO4会氧化双键,但题目中产物保留双键,实际应为Ag(NH3)2OH或新制Cu(OH)2,此处需注意高考命题逻辑:优先考虑醛→羧酸的常用氧化剂,若需保留双键,应选择温和氧化剂如O2/催化剂。
五、教学辅助可视化设计
1. 思维导图(核心知识框架)

2. 氧化反应规律总结表(学生记忆必备)

六、教学建议
分类梳理,强化逻辑:
按 “氧化强度 + 选择性” 分类,结合 “结构决定性质”(如醛基的还原性强于醇羟基,故弱氧化剂可氧化醛基),帮助学生理解氧化剂的适用范围。
对比记忆,突破易错点:
重点对比 “不同氧化剂氧化同一官能团的产物差异”(如醇的氧化)、“同一氧化剂氧化不同官能团的选择性”(如银氨溶液仅氧化醛基),通过表格和真题强化记忆。
方程式专项训练:
要求学生熟练书写核心反应方程式(如银镜反应、醇的催化氧化、酸性 KMnO4 氧化烯烃 / 甲苯),标注反应条件和产物结构,避免因方程式错误失分。
情境化教学:
结合有机合成路线题,设计 “试剂选择→产物推断→条件控制” 的递进式习题,提升学生的综合应用能力(如 “如何从乙醇制备乙醛?如何从乙醛制备乙酸?”)。
实验现象聚焦:
针对检验类考点(如醛、酚、烯烃的检验),总结 “试剂→现象→结论” 的对应关系,帮助学生快速解答选择题和实验题。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
钛(化学符号 Ti,原子序数 22)是一种具有优异综合性能的过渡...
关于亚铁离子与铁氰化钾的反应,简单来说,其核心产物是一种...
新型合金是指通过成分优化、微观结构调控、制备工艺创新形成...
纯净的铁块是银白色的,而铁粉是黑色的。这并非因为铁本身发...
1. 为什么大块的铁(或铁制品)是银白色的? 这主要归功于金属...
一、汞齐——汞是金属溶剂 1、汞齐,是一种汞与几种其他金属...