
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、单质硅的结构和性质
1、硅的存在
(1)形态:在自然界中只有化合态
(2)形式:二氧化硅和硅酸盐
2、晶体硅的结构
(1)构成微粒硅原子,作用力:共价键
(2)立体构型
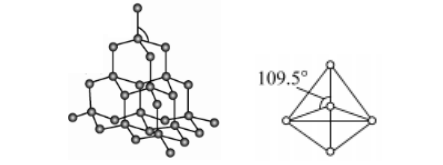
①基本构型:正四面体,杂化方式sp3
②键角:109.5°
③最小的环:六元环
④Si-Si键数/mol:2
3、物理性质
(1)色、态:晶体硅是灰黑色、有金属光泽的固体
(2)导电性:良好的半导体材料
4、化合价:最高正价为+4,最低负价为-4
5、稳定性:
![]()
6、还原性
(1)常温下与F2、HF、NaOH溶液反应
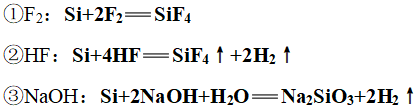
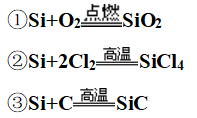
(2)高温下与O2、Cl2、C等化合
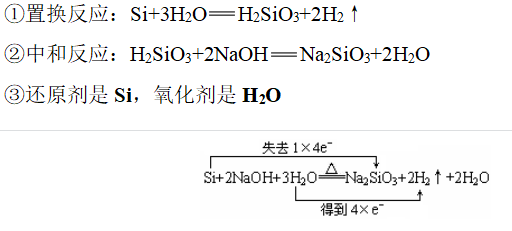
(3)Si与NaOH溶液反应的原理
7、工业制法
(1)流程一:
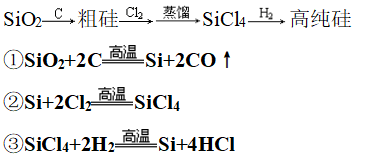
(2)流程二:
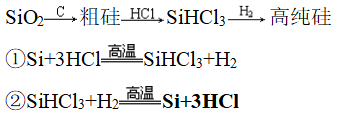
8、常见硅单质的制备

9、晶体硅的用途
(1)制造集成电路、晶体管、硅整流器等半导体器件
(2)制造太阳能电池等
10、硅单质的特殊性
(1)硅化学性质不活泼,但自然界中却没有游离态的硅。
(2)非金属单质一般为非导体,但Si为半导体。
(3)Si的还原性大于C,但C却能在高温下还原出Si:
![]()
(4)非金属单质跟强碱溶液作用一般无H2放出,但Si却能反应放出H2:
![]()
(5)非金属单质一般不与非氧化性酸反应,但硅却能与氢氟酸反应:
![]()
二、二氧化硅的结构和性质
1、物理性质:熔点高、硬度大,不溶于水
2、天然存在:水晶、玛瑙、石英、沙子、硅石的主要成分
3、二氧化硅的结构
(1)晶体类型:共价晶体
(2)立体结构
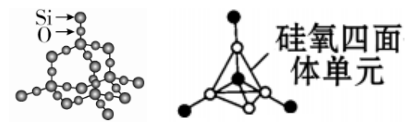
①基本构型:正四面体,杂化方式sp3
②键角:109.5°
③最小的环:12元环,含6个Si,6个O
④Si-O键数/mol:4
4、酸性氧化物
(1)与水反应:
![]()
(2)与碱发生复分解:
![]()
(3)与碱性氧化物化合:
![]()
(4)工业上制玻璃(难挥发性酸性氧化物制挥发性酸性氧化物)
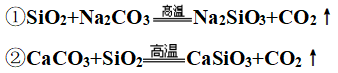
5、特殊反应
(1)反应:
![]()
(2)应用:雕刻玻璃
6、弱氧化性
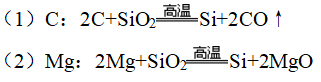
7、用途
(1)石英:石英玻璃用来制造耐高温化学仪器
(2)水晶:电子工业的重要部件,制造光学仪器、高级工艺品、眼镜片等
(3)玛瑙:制精密仪器轴承、耐磨器皿和装饰品等
(4)SiO2:制光导纤维
(5)沙子:建筑材料
三、硅酸和硅酸盐的性质
1、各种硅酸的结构
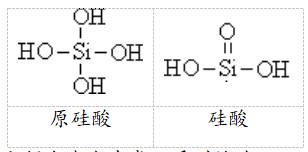
(1)原硅酸(H4SiO4)和硅酸(H2SiO3)
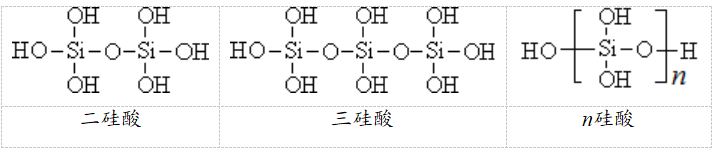
(2)多硅酸:原硅酸分子之间失去水生成一系列的酸
2、硅酸的性质
(1)物理性质:白色难溶于水的固体
(2)弱酸性:酸性比碳酸弱
①NaOH:
![]()
②Na2CO3:不反应
(3)热不稳定性:
![]()
(4)硅酸酸性的实验证明
①向NaOH溶液中加入几滴酚酞试液,溶液呈红色,加入适量硅酸,充分振荡,溶液红色消失,说明硅酸显酸性。
②向硅酸钠溶液中加入几滴酚酞试液,溶液呈红色,说明硅酸显酸性。
③测定硅酸钠溶液的pH,若pH>7,说明硅酸显酸性。
3、硅酸的制备:可溶性硅酸盐(Na2SiO3)和酸反应
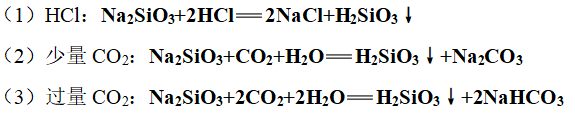
4、硅酸钠
(1)俗名:硅酸钠水溶液俗称水玻璃,硅酸钠固体俗称泡花碱
(2)弱酸盐:水溶液呈强碱性
(3)水玻璃的用途
①肥皂填料
②木材、织物的防腐剂和防火剂
③建筑工业上的粘合剂
④耐火材料
5、硅胶
(1)结构:网状多孔结构的无定形二氧化硅
(2)性质:具有强烈地吸水性
(3)用途:用做干燥剂、吸附剂和催化剂的载体
(4)制备:
![]() (硅胶)
(硅胶)
6、用氧化物形式表示硅酸盐的化学式
(1)原则
①化学式中各元素的化合价不变
②化学式中各元素的原子个数比不变
(2)书写顺序;活泼金属氧化物·不活泼金属氧化物·SiO2·H2O
(3)实例
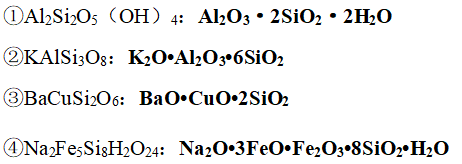
7、无机非金属材料
(1)传统无机非金属材料
①常见硅酸盐材料比较

②玻璃生产中的两个重要反应:
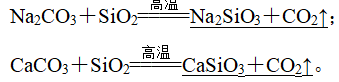
(2)新型无机非金属材料


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一 、 单质 碳的结构和性质 1、碳元素的存在形态 (1) 游离态...
一、 单质 硅的结构和性质 1、硅的存在 (1)形态:在自然界中...
...
...
...
硅,二氧化硅结构和性质和用途,硅酸,硅酸盐的性质、用途,知识...