
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高考备考中,关于硅的知识给同学们列出以下复习提纲:
1、概括为四大部分:
(1)硅的游离态——即硅单质
(2)硅的化合态——即硅的化合物(包括含硅元素的氧化物、酸、硅酸盐)
(3)硅的制取
(4)三大硅酸盐工业——水泥、玻璃、陶瓷
2、硅单质的五个方面:
(1)硅原子结构、基态硅原子价电子排布、晶体硅结构
(2)硅在周期表中的位置
(3)非金属单质硅的物理性质(色、态、密度、熔沸点、硬度、导热、导电)
(4)非金属单质硅的化学性质(金属性很强、失电子能力很强、还原性很强)
(5)硅的制备与用途
3、含硅元素的氧化物——二氧化硅
4、含硅元素的酸——硅酸(偏硅酸)
5、含硅元素的盐——硅酸钠及硅酸盐
6、自学延伸(一):无机非金属材料
7、自学延伸(二):硅烷
8、自学延伸(三):硅酸盐结构
9、自学延伸(四):对比学习总结C和Si、CO2和SiO2
硅,是地壳中含量仅次于氧的元素。硅土(又称二氧化硅)是一类硅酸盐矿物,也是沙、石英岩以及花岗岩的主要成分。不纯的非晶形硅可能最早在1811年便由Gay-Lussac和Thenard通过加热钾和四氟化硅得到,然而,说起硅元素,人们还是会将其发现归功于Berzelius,因为是他在1824年将通过上述方法所得的硅进一步润洗提纯而得到了纯硅。
随后,它被大量用于冶金工业中制硅铁合金、硅铝合金及硅钙合金等,化学工业中制得有机硅,电子工业中制半导体硅,在光学及光电子学中也有少量应用。如今已经可以利用电炉加热硅土(SiO2)与碳的混合物至远远高于硅熔点(1414℃)的温度(1900~2350℃)来实现硅的大规模生产。
硅是一种半导体材料,导电能力介于金属导体和绝缘体之间。计算机芯片中,施加一个很低的电压就足以使硅在导电状态和绝缘状态之间切换,产生二进制“1”和“0”的数字信号,从而完成逻辑操作。可以说,硅是一种重要的电子材料,以至于美国一个著名高技术园区就命名为硅谷。的确,如果没有硅,就没有当今相互连通的世界。
根据量子力学原理,物质中的电子自身不可能有任何多余的能量,只能占据原子一系列能级中的一个,在这个能级上自由移动,或可保证这种物质的导电性。比如在金属铜中,由于不同原子间的能级重叠,电子可以任意自由移动。但是,诸如硅那样的半导体中,电子需要一个推动力,把它们从低能级推到高能级才能导电。所以说硅是一种半导体材料。
从古到今,人类创造性地生产出了几大类硅酸盐产品——陶器、玻璃、水泥等,它们是使用量最大的无机非金属材料。其中,中国的陶器驰名世界,英文的“中国”(China)一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。日常生活中所用到的陶瓷,如日用器皿、建筑饰材、卫生洁具等,主要是传统硅酸盐陶瓷。它们都是以黏土为原料,经高温烧结而成的。
今天我们就来好好认识一下硅及其化合物。
第一部分
一、硅原子结构、基态硅原子价电子排布、晶体硅结构
1、硅原子结构
2、基态硅原子价电子排布
基态Si:1s22s22p63s23p2,简写为[Ne] 3s23p2
价电子排布为3s23p2。
硅主要的氧化态为+4。
价电子轨道表达式如图
![]()
3、硅晶体结构:属于立方晶系中的金刚石型结构
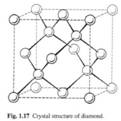
处在立方体顶角和面心的原子构成一套面心立方格子,处在体对角线上的原子也构成了一套面心立方格子。因此可认为硅晶体是由两套面心立方格子沿体对角线位移四分之一长度套构而成的。这种晶胞称为金刚石晶胞的立方晶胞。
二、硅在周期表中的位置、同位素、存在
1、硅在周期表中的位置
硅在元素周期表排行14,位于第三周期ⅣA族,在碳的正下方,属p区元素。在碳的正下方。
2、同位素
天然硅由28Si、29Si及30Si三种稳定同位素组成,其中丰度最大的是28Si。约占92.23%。此外,已发现的硅同位素还有25Si、26Si、27Si、31Si、32Si、33Si、35Si和36Si等放射性同位素。其中最重要的是31Si,常可用作硅的示踪同位素。
3、存在
硅在自然界分布很广,在地壳中,它是第二丰富的元素,构成地壳总质量的26.4%,仅次于第一位的氧(49.4%)。
硅对氧原子具有极大的亲和力,故自然界中无游离状态的纯硅,而主要以二氧化硅及硅酸盐(泥、石)等形式存在。此外,在大气、雨水、海水、低级生物乃至高等动物体内都含有极少量的硅化合物。比如,硅是人体必需的微量元素之一,占体重的0.026%。
三、非金属单质硅的物理性质(色、态、密度、熔沸点、硬度、导热、导电)
硅有晶体和无定形体两种。晶体硅的结构与金刚石类似,熔点、沸点较高,硬而脆。无定形硅是灰黑色粉末,具有金属光泽,性质较晶体硅活泼。
四、金属硅化学性质
1、与非金属单质(F2、O2、C、N2、Cl2)反应
Si+2F2===SiF4(常温下反应)
Si+O2![]() SiO2
SiO2
Si+C![]() SiC
SiC
3Si+2N2![]() Si3N4
Si3N4
Si+2Cl2![]() SiCl4
SiCl4
2、与强碱(NaOH)反应
Si+2NaOH+H2O===Na2SiO3+2H2↑
提醒:常见于强碱反应生成H2的固体单质有Al和Si,能够置换出H2O中氢的非金属
单质为碳,能够置换出H2O中氧的非金属单质为F2,这些特征反应常作为推断题的突破口。
3、与氢氟酸反应
Si+4HF===SiF4↑+2H2↑
玻璃中的二氧化硅(SiO2)成分同氢氟酸发生反应,生成了能挥发的四氟化硅气体和水。于是玻璃被腐蚀,成为毛玻璃。
这样,人们要在量筒、滴定管等玻璃化学仪器上进行刻度时,只要先将量筒等放在熔化了的石蜡中浸一下,用刀刮去刻度位置上的蜡,再涂上氢氟酸(或放在氰化氢气体中)进行腐蚀。由于氢氟酸不会与石蜡发生化学反应,被腐蚀的只是玻璃上刮去石蜡的地方,因此待洗去多余的氢氟酸和石蜡后,量筒等仪器上面便会显出蚀成的刻度线来。
要在玻璃器皿上刻上各种美丽的图案,也可以用上述的方法。氢氟酸真是雕刻玻璃的能手啊!
熔化石蜡→在玻璃上刷一层石蜡→刻花纹→在花纹处刷一层氢氟酸,放置15min→洗去石蜡
由于氢氟酸会腐蚀玻璃,因此氢氟酸不能储放在玻璃瓶中,而要放在聚乙烯塑料瓶中。
我们在做实验时,可将氢氟酸放在铅制的器皿中进行。因为铅制器皿经氢氟酸腐蚀后会在表面生成一层氟化铅(PbF2),保护铅不再被腐蚀。不过要注意,氢氟酸有毒,实验一定要在通风橱中进行。
五、硅的制取
1808年前后,也就是氢氟酸被发现不久,Berzelius将石英与铁、碳混合,加热后获得一种产物,他误认为这一产物就是“硅”。显然,Berzelius当时所得到的不过是一种硅铁合金。1809年,Dvy也从事制备单质硅的试验,但未获成功。两年之后,Gay L uCCaC与Thenard用金属钾同四氯化硅反应,得到一种棕色粉末,但可惜他们未能辨出这棕色粉末便是硅的单质。
到1823年,Berzelius又用钾还原氟硅酸钾的方法终于获得了硅单质,他所得到的是一种“无定形”黑色粉末。BeRZELiUS还用该制品确定了硅的若干主要性质。此后,他又应用Gay Luccac与Thenard曾经用过的方法制得了硅单质。为此,通常将发现与首次制备硅单质的荣誉归于Berzelius。
1857年,Sainte-Claire deville用从熔融铝中结晶的方法制成有金属光泽的片状硅。
SiO2+2C![]() Si+2CO↑
Si+2CO↑
微电子器件所需要的高纯硅的制备过程较为繁琐,通常涉及到由粗金属硅到氯硅烷的转变(含有硅氯键的化合物),经过分离提纯后由氢还原成多晶硅,再制成硅晶圆(光滑的薄盘)。主要反应过程如下:
① Si+2Cl2![]() SiCl4(易挥发的无色液体,遇潮湿空气发生强烈水解)
SiCl4(易挥发的无色液体,遇潮湿空气发生强烈水解)
SiCl4+2H2![]() Si+4HCl
Si+4HCl
② Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
SiHCl3+H2![]() Si+3HCl
Si+3HCl
六、硅的用途
1、高纯硅是最重要的半导体材料、集成电路元件、电子计算机元件,工业自动化用的可控硅都是半导体硅制成的;
2、作铝合金的添加剂;
3、是生产多晶硅(单质硅的一种形态)、有机硅(如硅酮橡胶等)的起始原料。
七、硅酸盐工业——水泥、玻璃、陶瓷
硅酸盐在生活生产中扮演着重要的角色,现代的水泥、玻璃,古代的陶瓷砖瓦是三大重要的硅酸盐产品,三者都是在高温条件下生产出来的。
1、水泥
(1)主要原料:黏土、石灰石
水泥是在各种建筑工程中广泛使用的建筑材料。以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏调节硬化速度,研成细粉就得到普通水泥。
(2)主要设备:水泥回转窑
(3)组成:硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)
(4)用途:重要的建筑材料
2、普通玻璃
(1)主要原料:纯碱、石灰石、石英砂(主要成分SiO2)
(2)制备原理:生产原理是两种碳酸盐和SiO2在高温条件下的反应,该过程遵循“高沸点物质制低沸点物质”的规律。
(3)主要设备:玻璃窑
(4)组成:硅酸钠、硅酸钙和二氧化硅
(5)用途:制化学实验用的玻璃仪器、窗玻璃等
3、陶瓷
(1)主要原料:黏土
陶瓷是以黏土为原料,经高温烧结而成的。陶瓷,以土为坯,以水相补,以金属矿物调和绘制,再以木为柴,以火烧造,终五行俱全,开物成器!
(2)主要设备:陶瓷窑
(3)组成:硅酸盐
(4)用途:在工农业、可以、生活、实验室中广泛使用
曾穿越大海和丝绸之路,走进欧亚各国皇室宫廷,在那里,中国的瓷器远胜于黄金,在那里,中国和瓷器已合成了一个单词-China。
第二部分
一、硅的氧化物——二氧化硅
大漠黄沙,古城残垣,沙子的主要成分是二氧化硅。二氧化硅是硅最重要的化合物,其存在形态有结晶形和无定形两大类,统称硅石。
硅藻土是无定形的二氧化硅,石英是常见的二氧化硅晶体,无色透明的纯石英叫水晶。紫水晶(含少量Mn)、烟水晶、碧玉、玛瑙、鸡血石等都是含有杂质的有色的石英晶体;蛋白石(又称猫眼石)是一种含部分水合石英的晶体聚集体,普通沙粒是混有杂质的石英细粒。以二氧化硅为主要成分的沙子也是基本的建筑材料;此外,信息高速公路的骨架——光导纤维,其主要成分也是二氧化硅。
1、晶体结构
构成二氧化硅晶体的基本结构单元是[SiO4]四面体,每个Si周围结合4个O,Si在中心,O在4个顶角。
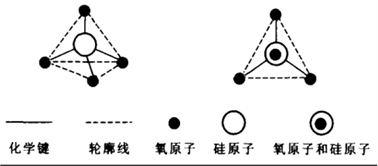
许许多多的这样的四面体又通过顶角的O相连接,就形成了这样一类似金刚石的空间立体网状结构。
可以看出每个O为两个四面体所共用,即每个四面体占有该O的1/2,所以说二氧化硅晶体是由Si和O按1:2的比例所构成的。因此用化学式SiO2来表示二氧化硅。
它仅仅表示构成二氧化硅的原子的最简个数比,而不能表示二氧化硅的实际组成方式。
2、物理性质
由于SiO2具有这样的空间立体网状结构,使得其硬度很大、熔点很高;利用这一物理性质可制成石英玻璃,比如实验室中的石英坩埚就很耐高温,加热时不易破裂。
3、化学性质
撒哈拉沙漠约形成于250万年前,是世界最大的沙质荒漠。250万年,撒哈拉依然是荒荒大漠、漫漫黄沙,这说明沙子的主要成分——SiO2,化学性质很不活泼,耐高温、耐腐蚀,不与水反应。
(1)与水不反应:SiO2是硅酸的酸酐,但不溶于水,不能与水直接化合生成硅酸。
(2)SiO2是酸性氧化物,具有酸性氧化物的通性。与碱性氧化物及强碱溶液反应。
与碱性氧化物反应:SiO2+CaO![]() CaSiO3
CaSiO3
利用该反应实现高炉炼铁中炉渣的去除。
与强碱溶液反应:SiO2+2NaOH===Na2SiO3+H2O
(3)与氢氟酸反应
SiO2在常温下与氢氟酸发生反应,生成四氟化硅气体和水
SiO2+4HF===SiF4↑+2H2O
生活中,氢氟酸可用于雕刻玻璃(含SiO2);实验室中,氢氟酸试剂不能用玻璃瓶盛放,而要用塑料瓶;其实都是这一原理。
(4)与盐(碳酸钠、碳酸钙)反应
SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
SiO2+CaCO3![]() CaSiO3+CO2↑
CaSiO3+CO2↑
二、硅酸
由于硅酸的组成随形成时的条件而变,常以通式xSiO2·yH2O表示。在各种硅酸中,以偏硅酸的组成最为简单,故常以H2SiO3化学式表示反应中产生的硅酸。(配图:市售天然水成分含有偏硅酸)
(1)弱酸性:H2SiO3不溶于水的二元弱酸(Ka1=3.0×10-10、Ka2=2.0×10-12),其酸性比碳酸弱,不能使指示剂变色,能与强碱反应。
H2SiO3+2NaOH===Na2SiO3+2H2O
(2)不稳定性:H2SiO3不稳定,受热易分解,反应的化学方程式为:
H2SiO3![]() SiO2+H2O
SiO2+H2O
(3)硅酸的制备
由于硅酸不溶于水且不与水反应,实验室用盐酸与可溶性硅酸盐作用即可制得。
如盐酸与Na2SiO3反应:Na2SiO3+2HCl===H2SiO3↓+2NaCl
说明:一开始没有出现白色沉淀,因为生成的单分子硅酸可溶于水,直到这些但硅酸缩合成多硅酸时,我们就得到了硅酸胶体——硅酸溶胶。
(4)硅胶
高浓度的硅酸极其容易聚合,逐步缩合成硅酸凝胶。在稀的硅酸溶液内加入电解质,或者在适当浓度的硅酸盐中加酸,则生成硅酸胶状沉淀(凝胶)。
硅酸凝胶为多硅酸,含水量高,软而透明,有弹性。如果将硅酸凝胶中大部分水脱去,则得到硅酸干胶(即硅胶)。
硅胶是一种稍透明的白色固态物质。硅胶内有很多微小的空隙,内表面积很大(每克硅胶内表面可达800~900m2因此硅胶有很强的吸附性能,可做吸附剂、干燥剂和催化剂的载体。例如实验室常用变色硅胶作为精密仪器的干燥剂。变色硅胶内含有氯化钴,无水时CoCl2呈蓝色,含水时Co(H2O)6呈粉红色,氯化钴颜色的变化,可显示硅胶的吸湿情况。粉红色的硅胶已失去吸湿能力,需要烘烤、脱水,又变成蓝色后,才重新恢复吸湿能力。
三、含硅元素的盐
天然硅酸盐作为人类建筑材料的历史可谓源远流长。现存的遗迹中,金字塔、万里长城等可作为这方面的典型例证。
天然硅酸盐进过初步加工予以利用的最初记录是陶器。陶器的出现标志人类文明的一大进步,我国西安半坡村博物馆展出的六千年前的部分陶盆、陶罐,其图案之精美,质地之光洁,堪称杰作!
古代人类在硅酸盐工艺方面取得的另一重大成就就是玻璃。据认为,玻璃制造的发祥地是埃及。据传古埃及的某些湖岸盛产天然碱(硅酸钠)。人们发现,当天然碱和砂石混合,在经高温熔化,便可得到一种美丽透明的物块,这就是玻璃!(蚌埠玻璃)
1、硅酸钠Na2SiO3
(1)物理性质:是极少数可溶于水的硅酸盐中的一种,无色、淡黄色或青灰色透明的粘稠液体,俗称泡花碱,溶于水呈碱性,其水溶液俗称水玻璃,具有黏性,是建筑用的黏合剂。熔点1410℃,沸点2355℃,具有腐蚀性、强刺激性,可致人体灼伤。
(2)化学性质
Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3
(3)应用
用作分析试剂、织物防火剂和黏合剂,也是硅胶、分子筛、沉淀法白炭黑等硅系列产品的原料。
(4)Na2SiO3工业发展
1818年,德国学者约翰·富克斯制得水玻璃,并发表了很多有价值的研究成果。1826年德国奥格斯堡首次建立了一座小型水玻璃工厂。我国于1938年开始在北京、天津、青岛、广州等地建设硅酸钠生产工厂。发展至今,我国硅酸钠生产能力已居世界第一位。2017年产量已经达到300多万吨(以固体计),大约占到了世界总产量的50%。
2、硅酸盐
(1)硅酸盐是由硅、氧和金属元素组成的化合物的总称,存在于地球的每一个角落,是一大类结构复杂的固态物质,大多不溶于水,化学性质很稳定。
(2)组成及表示方法
对于简单硅酸盐,我们一般直接用化学式来表示。而对于复杂的硅酸盐,我们一般用其组成元素所对应的氧化物来表示。若硅酸盐中含有多种金属元素,就稍复杂一点,要注意:活泼金属氧化物写在前,不活泼金属氧化物写在后。
第三部分
一、炼钢炉内硅元素的氧化
炼钢先炼铁。钢从生铁而来。用铁矿石冶炼而得的生铁,含碳量较高,而且含有许多杂质(如硅、锰、磷、硫等)。为了清除金属中的杂质,其中最主要的环节就是造渣和除渣。其原理是在高温下利用各种来源的氧,把生铁里面的杂质氧化清除到一定的程度,以得到一定成分和一定性质的铁碳合金——钢。
下面我们来看看其中硅杂质的氧化。
硅与氧有较大的亲和力,因此硅的氧化很迅速,它在冶炼初期就已经完全被氧化而生成SiO2:
Si+2FeO![]() SiO2+2Fe
SiO2+2Fe
同时SiO2又和FeO反应形成硅酸盐:
2FeO+SiO2![]() 2FeO·SiO2
2FeO·SiO2
这种盐是炉渣中很重要的一部分,它与CaO作用生成稳定化合物2CaO·SiO2和FeO,前者牢固存在于炉渣中,因而达到了去硅的目的。后者变成了渣中的游离成分,使渣中FeO的含量增加,对促进杂质的氧化是比较有利的。其反应如下:
2FeO·SiO2+2CaO![]() 2CaO·SiO2+2FeO
2CaO·SiO2+2FeO
你还记得在高炉炼铁中石灰石的造渣作用吗?不就是上面我们所叙述的过程吗?这次你明白了吧!
二、分子筛(沸石)
人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂。
沸石(Zeolite)是一种矿石,最早发现于1756年。瑞典的矿物学家克朗斯提(Cronstedt)发现有一类天然硅铝酸盐矿石在灼烧时会产生沸腾现象,因此命名为“沸石”(瑞典文Zeolit)。在希腊文中意为“沸腾”(ZEO)的“石头”(Lithos)。此后,人们对沸石的研究不断深入。
沸石有独特的多空腔结构,晶体矿石内部充满了细微的孔穴和通道,所以沸石晶体矿石分子筛对于气体和液体分子就犹如筛子一样,根据分子的大小来决定是否被吸附。
三、石英玻璃
石英在1600℃时熔化成粘稠液体,其内部结构变为不规则状态,若急剧冷却,因粘度大不易再结晶而形成石英玻璃。
石英玻璃具有许多特殊性能,纯度高、机械强度高、化学稳定性好、光谱透过宽、抗热冲击、耐高温变形、耐射线辐照和电绝缘等。
如加热至1400℃时也不软化(普通玻璃加热至600~900℃即软化);热膨胀系数小,所制容器骤冷、骤热均不易破裂;可透过可见光和紫外光,因而可用于制造高级化学器皿和光学仪器;高纯石英玻璃的另一个重要作用是制光导纤维,用在光导通讯上,石英类光导纤维是光通讯的重要原料,它将逐步取代电缆。
四、硅的同素异形体的新型硅——Si24
2014年,美国华盛顿卡内基研究所的提摩西·斯特罗贝尔和同事宣布制造出一种新型硅——Si24,这是硅的一次华丽变身,它仅仅通过原子紧缩就可以变成直接“带隙”,从而提高光电转换效率。
所谓“带隙”,就是实现半导体材料中的电子从低能级推到高能级所需的推动力,一旦“跃级”成功,最终的结果就是实现导电。对于半导体芯片,使得电子跨越能量“带隙”并产生电流的推动力,是电压;而在太阳能电池中,这个推动力则是太阳光的光子。
Si24的诞生最直接的优越性能表现为使太阳能电池的转换效率超过传统最优秀的硅太阳能电池的转换效率,可成功应用于太阳能电池和计算机芯片的制造。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锰(Mn)是元素周期表第四周期第 ⅦB 族的过渡金属元素,原子...
镁(Mg,原子序数 12,第 ⅡA 族碱土金属元素)是典型的活泼金...
在第ⅡA族(碱土金属)元素家族中,铍(Be)以其极致的轻金属特性、...
1.皓矾: ZnSO 4 ·7H 2 O 2.钡餐,重晶石: BaSO 4 3.绿矾,皂矾,青矾...
少量、适量、足量和过量,这几个词是化学实验和计算中的核心...
一、基础概念:从 “温度强度” 看五者的核心差异 首先需明确...