
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、铝合金
1、铝

(1)Al的物理性质:银白色金属。导电能力好,是导电的主要材料。延展性好,可代替锡做铝箔制品。铝可以制成合金,比铁的密度小,代替钢铁广泛用做建筑材料和机械材料。
(2)Al的原子结构:最外层3个电子,较易失去电子,显示很强的还原性,但比钠和镁差一点。
(3)Al的化学性质
①铝的金属性很强,但常温下在空气中却表现很稳定,原因是铝能在金属表面自动形成一层致密保护膜。这层膜保护了内部的Al不会被空气中的氧气氧化。(镁也有这种现象,所以镁在常温下表现很稳定)
【铝汞齐实验】:将汞滴在表面氧化膜被破坏的铝的表面上,汞与铝形成合金,阻止了致密氧化膜的形成,使得铝与空气中的氧气不断反应形成白色氧化铝,随着氧化物的生长,最终形成很长的白色纤维。此实验能证明铝非常活泼。

②铝和其它金属一样,能和Cl2、O2、Br2、S、I2、稀盐酸、稀硫酸、稀硝酸、CuSO4溶液、FeCl3溶液等反应。
③铝是亲氧元素,在高温下表现出很强的活泼性,与很多不太活泼的金属氧化物反应,生成Al2O3和另一种金属,并放出大量热,这种反应叫铝热反应。
比如铝能与Fe2O3在高温的引发下,会发生剧烈反应,放出大量能量,反应方程式为2Al+ Fe2O3 2Fe+Al2O3。
2Fe+Al2O3。
④铝还能和NaOH溶液反应,生成NaAlO2(偏铝酸钠)。
【推理】【实验】2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2、Al2O3的性质

(1)物理性质:
粉末状的纯净Al2O3为白色,天然晶体状的带有其它金属元素,呈现各种颜色。红宝石、蓝宝石、刚玉的主要成分都是Al2O3。
熔点为2054℃,沸点为2980℃,熔沸点很高,可用作耐高温材料。
晶体状的Al2O3有很高硬度(摩氏硬度为9),其硬度仅次于金刚石,可用作耐磨材料。
(2)化学性质:两性氧化物。既能和酸反应,又能和碱反应。
【推理】与盐酸反应:
Al2O3+6HCl=2AlCl3+3H2O
与NaOH溶液反应:
2NaOH+Al2O3=2NaAlO2+H2O
3、Al(OH)3的性质

(1)物理性质:白色固体,在水溶液中生成时,呈胶状物。
(2)化学性质:两性氢氧化物。看作碱时,是三元碱,能和酸反应。看作酸时,又叫一水合偏铝酸(HAlO2·H2O),是一元酸,能和碱反应。
【推理】与盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O
与NaOH溶液反应:Al(OH)3+NaOH =NaAlO2+2H2O
4、Al3+可溶性盐溶液中滴加NaOH溶液的实验
【推理】【实验】
(1)现象:先生成白色胶状沉淀,后来沉淀慢慢溶解。
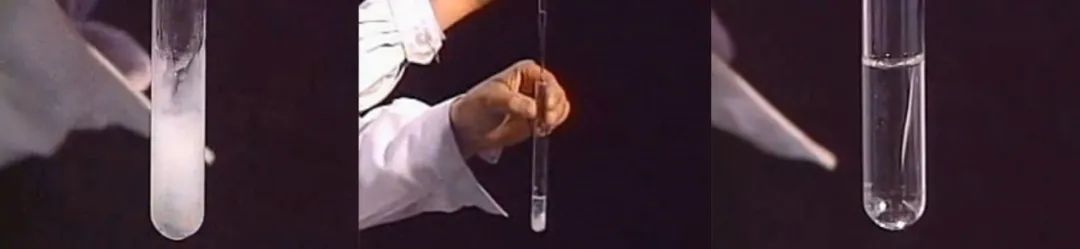
(2)先后发生的离子反应分别是:
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
(3)过量问题,写出Al3+可溶性盐中加入少量NaOH和过量NaOH的离子方程式:
Al3++3OH-(少量)= Al(OH)3↓
Al3++4OH-(过量)=AlO2-+2H2O
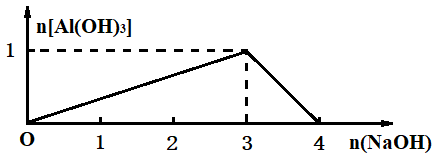
(4)画出Al3+可溶性盐中滴加NaOH溶液时生成Al(OH)3的物质的量与加入NaOH物质的量的关系图像
二、铁合金
1、金属材料的使用发展史:

(1)金在史前时期已经被认知及高度重视。它可能是人类最早使用的金属,被用于装饰及仪式。
(2)大约公元前7000年前,伊朗西部的一些地区就已经使用小型铜器件。
(3)公元前4000年前后,进入青铜器时代。
(4)公元前3700年,埃及人就已经使用锡器。
(5)公元前2500年,西亚的赫梯人已经会冶炼和使用铁器。
(6)1886年,电解法制铝成功,铝合金开始得到广泛应用。
(7)1947年,人们开始在工厂里冶炼钛,钛合金开始使用。
2、合金
(1)合金指一种金属与另一种或几种金属或非金属经过混合熔化,冷却凝固后得到的具有金属性质的物质。多数合金是混合物。
(2)合金具有许多优良的物理、化学、机械性能。这些性能可以通过改变合金元素的种类、含量和生成合金的条件来调节。
(3)合金性能的改变是由于金属结构的改变造成。比如硬度变大,是由于纯金属中原子有规则的层状排列被其它元素的原子破坏,使原子层之间的相对滑动变得困难。
3、铁合金
(1)包括生铁和钢,它们都是铁碳合金。
生铁的含碳量高,在2%-4.3%。生铁的硬度大,抗压强,性脆,可以铸造,制造机座、管道等。
钢的含碳量低,在0.03%-2%。钢的延展性好,机械性能好,可以锻轧,制造各种机械。
(2)钢又分为碳素钢和合金钢。
碳素钢分为高碳钢、中碳钢、低碳钢。含碳量越高,硬度越大,含碳量越低,韧性越好。分别可以用来制作刀具、钢轨、钢丝等。
合金钢又叫特种钢,是在碳素钢里加入适量的其它金属。特种钢在强度、硬度、可塑性、韧性、耐磨、耐腐蚀等方面有更好的表现。
不锈钢是合金钢的一种,主要由铁、铬(Cr)、镍(Ni)组成,不易生锈,有很强的抗腐蚀能力。
三、新型合金
1、储氢合金:能够大量吸收H2,并能与H2结合成金属氢化物的合金。如Ti-Fe合金、La-Ni合金。
好的储氢合金的特点:储氢量大,室温下吸收和释放H2的速度快。
它为氢能的使用提供材料支持。
2、钛合金:以钛为主要金属的合金。
钛合金具有密度低、比强度高、耐蚀性好、导热率低、无毒无磁、可焊接、生物相容性好、表面可装饰性强等特性,广泛应用于航空、航天、化工、石油、电力、医疗、建筑、体育用品等领域。
钛还能承受很高的压力,可制作潜艇。
3、还有耐热合金、形状记忆合金等。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的,...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠...