
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素推断题是高考考查的热点,这类题往往将元素化合物的知识、物质结构理论、化学基本理论等知识串联起来,综合性较强,难度较大。解题的关键是正确推断元素,推断元素的突破口在于抓住“题眼”,其中等电子微粒就是考查热点之一。等电子微粒属于基础概念,特别在物质推断题中出现的频率很高,本文就此做一归纳指导。
一.常见的几组等电子微粒
1.“10电子”微粒
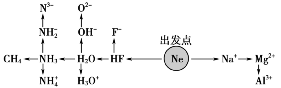
寻找“10电子”微粒的思路是:从10号元素作为切入点,(1)往前每减一个序数,相当于减少一个电子,①用H原子补齐,得到分子;②因为H+不带电子,在分子的基础上减去一个H+得到相应阴离子,如由HF得到F-;③在分子的基础上加上一个H+得到相应复杂阳离子,如由H2O得到H3O+;(2)往后每加一个序数,相当于增多一个电子,减去一个电子,得到简单阳离子,如由Na得到Na+。
2.“18电子”微粒
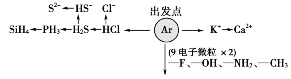
寻找“18电子”微粒的思路是:从18号元素作为切入点,(1)往前每减一个序数,相当于减少一个电子,①用H原子补齐,得到分子;②因为H+不带电子,在分子的基础上减去一个H+得到相应阴离子,如由HCl得到Cl—,由H2S得到HS-和S2-;(2)9加9法:CH3-CH3,CH3-NH2,CH3-OH,CH3-F,NH2-OH,HO-OH,F-F,NH2-NH2等;(3)在上述基础上,减H+法:如H2O2→HO2-→O22-。
3.其他几组等电子微粒
(1)“2电子”微粒:H2←H-←He→Li+→Be2+等;
(2)“14电子”微粒:Si、N2、CO、C2H2、C22-、HCN、CN-等;
(3)“16电子”微粒:S、O2、C2H4、HCHO等。
【雾点警示】质子数和核外电子数分别相等的两种微粒关系
(1)可以是两种原子,如同位素原子;
(2)可以是两种分子,如CH4、NH3等;
(3)可以是两种带电荷数相同的阳离子,如NH4+、H3O+;
(4)可以是两种带电荷数相同的阴离子,如OH-、F-。
二、等电子微粒之间的反应
1.10电子微粒间的反应
OH-+H3O+=2H2O
NH2-+NH4+=2NH3↑
NH4++OH-= NH3↑+H2O
NH3+HF=NH4++F-
NH3+H3O+=NH4++H2O
NH2-+H3O+=NH3↑+H2O
Mg2++2OH-=Mg(OH)2↓
Al3++3OH-=Al(OH)3↓
Al3++4OH-=AlO2-+2H2O
2.10电子微粒与14电子微粒、18电子微粒间的反应
2F2+2H2O=4HF+O2
C2H2+H2O =CH3CHO
CO+H2O =CO2+H2
H2S+OH-=HS-+H2O
HS-+OH-=S2-+H2O
H2S+2OH-=S2-+2H2O
S2-+H2O= HS-+OH-
NH3+H2S=NH4HS+H2O
2NH3+H2S=(NH4)2S+H2O
等电子微粒、等电子体辨析
(1)等电子体是指总原子数相同,总的最外层电子数也相同的微粒。
①等电子体总电子数目不一定相同,只强调最外层总电子数相同;
②等电子体之间结构、性质有相似之处。
(2)等电子微粒是指相同电子数的微粒,如果是单核微粒,又称为电子层结构相同的微粒。
①不论总原子数是否相等,只要总电子数相等就可以。
②等电子微粒之间,结构没有可比性,性质也千差万别。
典例剖析
典例1.下列各组中两种微粒所含电子数不相等的是( )
A.H3O+和OH- B.CO和N2 C.HNO2和NO2-D.CH3+和NH4+
解析:A.H3O+和OH-均含有10个电子;B.CO和N2均含有14个电子;C.HNO2和NO2-均含有24个电子;D.CH3+中含有8个电子,而NH4+含有10个电子。
答案:D
典例2.A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:①A++C-===D+E↑;②B++C-===2D。请回答:
(1)C-的电子式是__________。
(2)分别写出A+和D反应、B+和E反应的离子方程式_______、_______。
(3)除D、E外,请再写出两种含10个电子的分子的分子式__________。
解析:本题中五种粒子均有10个电子是解题的突破口。依据已有的元素与化合物知识可知,10个电子的粒子中,原子有Ne;阴离子有N3-、O2-、F-、OH-、NH2-;阳离子有Na+、Mg2+、Al3+、NH4+、H3O+;分子有CH4、NH3、H2O、HF。根据题意有①A++C-===D+E↑,推知A+应为NH4+,C-为OH-、D为H2O、E为NH3,将其结果代入②B++C-===2D,推知B+应为H3O+。
答案: (1)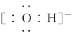
(2)NH4++H2O⇌NH3·H2O+H+ H3O++NH3===NH4++H2O
(3)CH4、Ne、HF(任选两种)
实战演练
用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)a元素是________,B元素是________,C元素是________。(用元素符号表示)
(2)D是由两种元素组成的双原子分子,其分子式是________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是______。
(4)F是由两种元素组成的三原子分子,其分子式为________。
(5)G分子中含有4个原子,其分子式是_____________________。
(6)H分子中含有8个原子,其分子式是_______________。
答案: (1)K Cl S (2)HCl (3)F2(4)H2S (5)H2O2(或PH3) (6)C2H6

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...
一、常见三种原子半径的标准 首先我们说说原子半径有几种不同...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长...
...