
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氢键的形成条件
参考文献:
1、周公度《结构和物性—化学原理的应用》第三版P95和P78
2、麦松威《高等无机结构化学》P333
3、徐光宪《物质结构》P586
氢键以X-Y…H表示,其中X和Y的电负性越大,半径越小,则氢键越强。如N、O、F。
C的电负性不够大,但是与它连接的原子可以改变C的电负性,比如Cl3C-H、NC-H它们的H可以形成氢键,Cl电负性大,但是半径也大,所以O-H…Cl很弱,同理O-H…S也很弱。
这里,X-H的一对成键电子和Y的一对孤对电子参与成键,所以氢键是三中心四电子键(3c-4e)。也就是说,如果Y没有孤电子,一般是不能形成氢键的,比如NH4+,只能H去形成氢键,而N已经没有孤电子了!
二、非常规氢键
1、上面的氢键属于一对一的情况,即一个H对一对孤电子。但也有发现一个H对多个孤电子,还有一对孤电子对多个H的情况。
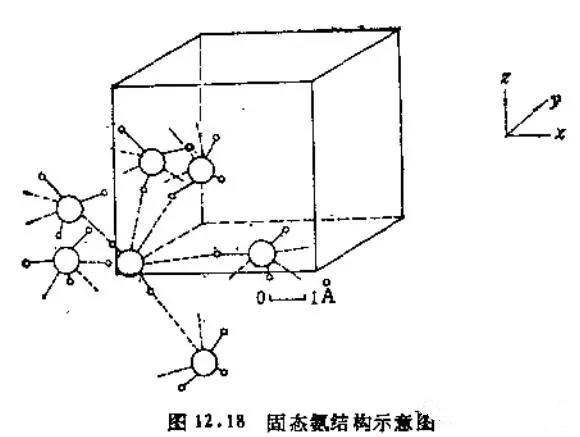
例如,固态NH3中,一个N通过氢键与其他3个H连接,因此一个N一共连接6个H,如下图(来源于《无机化学丛书》第四卷P37)
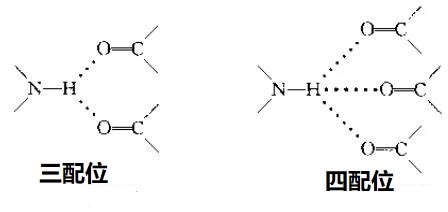
下图为一个H对多个孤电子的情况(来源于周公度《结构化学基础》第三版P224)
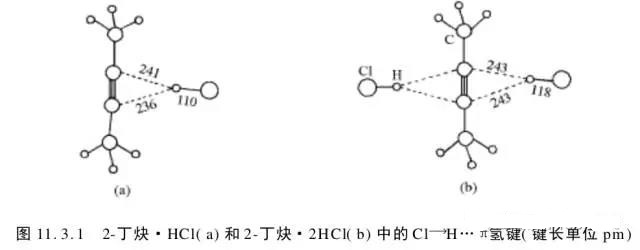
2、π键也可以形成氢键,如下图(麦松威《高等无机结构化学》P341)
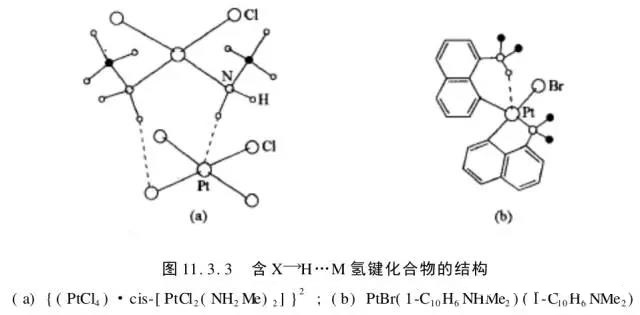
3、金属也可以形成氢键X-H…M(麦松威《高等无机结构化学》P342)
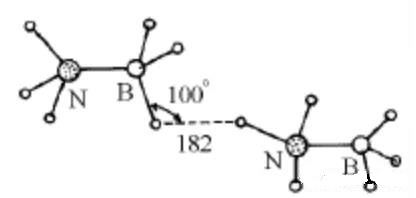
4、X-H…H-Y二氢键(麦松威《高等无机结构化学》P343)
比较下列物质的熔点
H3C-CH3 | H3C-F | H3N→BH3 |
-181℃ | -141℃ | 104℃ |
可以看出,H3N→BH3的熔点出奇的高,因为其晶体中含有N-H…H-B二氢键

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一般来说,同主族元素形成的R-R键键能从上至下,键长逐渐增大...
离子极化与影响元素 离子极化理论是离子键理论的重要补充。...
原子之间形成共价键时,若共用电子对只是由一方原子提供电子...
p区元素化学的学习中我们常常发现,很多非金属含氧酸的游离酸...
不是的。 只能提供一对孤对电子与中心原子形成配位键,被称为...
磷的含氧酸共有四种: 磷酸(H 3 PO 4 ),结构式 :三元中强酸...