
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、浓度不同
①C+O2(不充足)![]() 2 CO
2 CO
C+ O2(充足)![]() CO2
CO2
②2P+3Cl2(不充足)![]() 2PCl3
2PCl3
2P+Cl2(充足)![]() 2PCl5
2PCl5
③2H2S+3O2(不充足)![]() 2S+2H2O
2S+2H2O
2H2S+3O2(充足)![]() 2SO2+2H2O
2SO2+2H2O
④Zn+4HNO3(浓)==Zn(NO3)2+2NO↑+2H2O
3Zn+8HNO3(稀)==3Zn(NO3)2+2NO↑+4H2O
4Zn+10HNO3(极稀)==4Zn(NO3)2+NH4NO3+3H2O
⑤Ba(OH)2+SO2(少量)==BaSO3↓+H2O
Ba(OH)2+SO2(少量)==Ba(HSO3)2
⑥2NaHCO3+Ca(OH)2(少量)==CaCO3↓+Na2CO3+2H2O
NaHCO3+Ca(OH)2(足量)==CaCO3↓+NaOH+H2O
⑦6FeBr2+3Cl2(不足)==4FeBr3+2FeCl3
2FeBr2+3Cl2(过量)==2Br2+2FeCl3。
2、温度不同
①NaCl+H2SO4(浓)==NaHSO4+HCl↑
2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②Cl2+2NaOH==NaCl+NaClO+H2O
3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
③P2O5+H2O(冷)==2HPO3
P2O5+3H2O(热)==2H3PO4
④4Na+O2==2Na2O
2Na+O2![]() Na2O2
Na2O2
⑤Fe+HNO3(冷、浓)→钝化
Fe+6HNO3(冷、浓)=Fe(NO3)2+3NO2↑+3H2O
⑥C2H5OH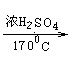 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2C2H5OH![]() C2H5OC2H5+H2O
C2H5OC2H5+H2O
3、顺序不同
①Al3++3OH-==Al(OH)3↓(向AlCl3溶液中滴加NaOH溶液)
Al3++4OH-==AlO2-+2H2O(向NaOH溶液中滴加AlCl3溶液)
②AlO2-+H++H2O==Al(OH)3↓(向NaAlO2溶液中滴加HCl溶液)
AlO2-+4H+==Al3++2H2O(向HCl溶液中滴加NaAlO2溶液)
③Na2CO3+HCl==NaCl+NaHCO3(向Na2CO3溶液中滴加HCl溶液)
Na2CO3+2HCl==2NaCl+H2O+CO2↑(向HCl溶液中滴加Na2CO3溶液)
④AgNO3+NH3·H2O==AgOH↓+NH4NO3(向AgNO3溶液中滴加NH3·H2O溶液)
AgNO3+3NH3·H2O==[Ag(NH3)2]OH+NH4NO3+2H2O(向NH3·H2O溶液中滴加AgNO3溶液)
4、介质不同
①2Al+6HCl==2AlCl3+3H2↑
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
②2KMnO4+5K2SO4+3H2SO4==6K2SO4+2MnsO4+3H2O
2KMnO4+K2SO4+3H2O==3K2SO4+2MnO2↓+2KOH
2KMnO4+K2SO4+2KOH==K2SO4+2K2MnO4+H2O
③CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
5、催化剂不同
![]() + 3 Cl2
+ 3 Cl2![]() C6H6Cl6
C6H6Cl6
![]() + Cl2
+ Cl2![]()
![]() —Cl +HCl
—Cl +HCl

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。少量、适量、足量和过量,这几个词是化学实验和计算中的核心定量描述,区别主要在于反...
一、基础概念:从 “温度强度” 看五者的核心差异 首先需明确:这五种操作本质都是 “...
【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...