
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
铜及其化合物的知识尽管在教材中没有单独成节进行系统讲述,但在高考中还是经常涉及,下面对其性质略作归纳,供同学们复习时参考:
一、铜
亮红色重金属,易导电,具有良好的延展性,易加工,我国早在商代就开始使用青铜器,其用途极为广泛。
(1)与非金属反应
2Cu + O2![]() 2CuO(黑色)(可利用该反应除去氧气) 2Cu + S
2CuO(黑色)(可利用该反应除去氧气) 2Cu + S![]() Cu2S
Cu2S
(2)和金属阳离子反应
Cu + 2Ag+===Cu2++ 2Ag
Cu + 2Fe3+===Cu2++ 2Fe2+(在无线电工业上,常利用溶液来腐蚀铜,以制造印刷线路板)。
(3)和强氧化性酸反应(铜不能与稀盐酸或稀硫酸反应放出氢气)
3Cu + 8HNO3(稀)===3Cu(NO3)2+2NO↑+ 4H2O
Cu + 4HNO3(浓)===Cu(NO3)2+2NO2↑+ 2H2O
Cu + 2H2SO4(浓)===3CuSO4+2SO2↑+ 2H2O
(4)在潮湿的空气中锈蚀,生成碱式碳酸铜。俗称铜绿
2Cu + CO2+H2O + O2===Cu2(OH)2CO3
二、氧化铜
黑色难容固体,可溶于酸。对热很稳定,只有在超过1273K时,才会分解放出氧气,并生成Cu2O。
(1)和酸反应
CuO + 2H+===H2O + Cu2+(蓝色溶液)
(2)和还原剂反应
CuO + CO![]() Cu + CO2
Cu + CO2
3CuO + 2NH3![]() 3Cu + N2+3H2O(该反应式经常出现考试题中)
3Cu + N2+3H2O(该反应式经常出现考试题中)
CH3CH2OH + CuO![]() CH3CHO + Cu+ H2O
CH3CHO + Cu+ H2O
三、Cu2+及铜盐
铜盐溶液呈蓝色,无水硫酸铜为白色粉末,溶于水或形成蓝矾晶体呈蓝色。
(1)和碱反应
Cu2++ 2OH-===Cu(OH)2↓(蓝色絮状沉淀)
Cu2++ 2NH3·H2O===Cu(OH)2↓+ 2NH4+(氨水少量时)
Cu(OH)2+4NH3=== 2OH-+ [Cu(NH3)4]2+(深蓝色溶液)(氨水足量时)
(2)和H2S、HS-、S2-反应
虽然Cu2+具有一定的氧化性,但和H2S、HS-、S2-发生离子反应生成沉淀,而不是发生氧化还原反应,Cu2++ H2S===CuS↓+ 2H+。
(3)和具有还原性的金属反应
Cu2++ Fe=== Cu+Fe2+
四、氢氧化铜
蓝色固体,不溶于水,能溶于氨水形成络合物,Cu(OH)2的热稳定性比碱金属氢氧化物差的多,受热脱水分解生成黑色的氧化铜(CuO)。
新制的碱性氢氧化铜悬浊液,可以与含有醛基的醛类、甲酸、甲酸某酯类、甲酸盐以及葡萄糖等发生反应,如:
CH3CHO + 2Cu(OH)2![]() CH3COOH + Cu2O↓+ 2H2O
CH3COOH + Cu2O↓+ 2H2O
五、铜盐的电解
2CuSO4+2H2O![]() 2Cu + O2↑+ 2H2SO4
2Cu + O2↑+ 2H2SO4
CuCl2![]() Cu + Cl2↑
Cu + Cl2↑
六、铜的精炼
以粗铜为阳极、纯铜为阴极、CuSO4溶液为电解液进行电解,可将粗铜提纯。
【例题1】铜是生命必需元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响,在化学反应中,铜元素可表现为0、+1、+2。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式:________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:_______________。这层铜绿可以用化学方法除去,试写出除去铜绿而不损伤器物的化学方程式:____________。试写出保护铜制品的方法:__________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。是从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃)。
解析:(1)曾青(CuSO4)跟铁反应的化学方程式:CuSO4+Fe===Cu+FeSO4,对应的离子方程式为:Cu2++ Fe===Cu+Fe2+;(2)2Cu + CO2+H2O + O2===Cu2(OH)2CO3除去铜绿而不损伤器物不能选择强氧化性酸,只能选择盐酸、稀硫酸、醋酸等,有关的方程式为:Cu2(OH)2CO3+4HCl=== 2CuCl2+CO2↑+ 3H2O,根据铜生成铜绿的条件,应将铜制品放在干燥的空气中保存。(3)根据题给信息以及做货币的实际,选择铜做货币是因为铜的熔点比较低,容易冶炼铸造成型;铜的化学性质比较稳定,不易被腐蚀等。
答案:见解析(略)。
【例题2】某化学兴趣活动小组为探究铜跟浓H2SO4的反应,用如图所示装置进行有关实验。实验中甲同学将a g Cu片12 mL 8 mol·L-1的浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu片剩余。
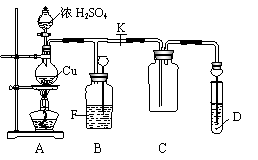
请回答下列问题:
(1)写出Cu与浓H2SO4反应的化学方程式:____________________。
(2)装置D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是____________。实验装置D有可能造成环境污染,试用最简单的方法加以解决(实验用品自选)_______________。
(3)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生。此时b装置中的现象是_______________。
(4)F中应放置的液体是________(填字母)。
A.饱和Na2SO3溶液 B.酸性KMnO4溶液 C.浓溴水 D.饱和NaHSO3溶液
(5)为什么有一定量的余酸但未能使Cu完全溶解,你认为原因是____________。
(6)下列足量药品能够用来证明反应结束后的烧瓶中确有余酸的是_____(填序号)。
A. Fe粉 B. BaCl2溶液 C. Ag D. Na2CO3溶液
(7)甲同学向A中反应后的溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是_____(填名称),反应方程式是____________。
解析:本题考查Cu与浓H2SO4反应的相关知识,Cu与浓H2SO4反应的产生的SO2可以使品红溶液褪色,SO2可以用NaOH溶液吸收。B装置的作用是贮存多余的气体,所以F中应盛放饱和NaHSO3溶液,以减小SO2的溶解。随着反应的进行,浓H2SO4的浓度不断减小,Cu与稀H2SO4不反应,所以虽然有一定量的余酸但未能使Cu完全溶解。要使Cu完全溶解,应该加入氧化剂,通入的单质气体应为O2,不引入新的杂质。
答案:(1)Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O(2)品红溶液褪色用浸有NaOH溶液的棉花团塞在试管口(3)F中液面下降,长颈漏斗中液面上升(4)D(5)随着反应进行,浓H2SO4的浓度不断减小,Cu与稀H2SO4不反应(6)A D(7)氧气
CuSO4+SO2↑+ 2H2O(2)品红溶液褪色用浸有NaOH溶液的棉花团塞在试管口(3)F中液面下降,长颈漏斗中液面上升(4)D(5)随着反应进行,浓H2SO4的浓度不断减小,Cu与稀H2SO4不反应(6)A D(7)氧气
2Cu + 2H2SO4+O2===2CuSO4+2H2O
点拨:有关Cu与浓H2SO4的反应一直是历年高考的热点,考查对浓硫酸及性质等基础知识的应用和迁移。从最熟悉的物质、反应出发,进一步探究它们的性质是最常见的考查形式。硫和氮族元素在教材中是以化工产品和环境定位的,因此在考查这两种元素时。常结合资源开发和环境保护等进行命题,如本题在D的试管口塞一团浸有NaOH溶液的的棉花来吸收SO2,就体现了环保意识。浓H2SO4与金属反应时应注意三种情况:
(1)浓H2SO4常温下使Fe、Al发生钝化,体现了浓H2SO4的强氧化性。
(2)浓H2SO4与Zn反应先生成SO2,随着反应进行,浓H2SO4变稀,稀H2SO4与过量的Zn反应生成H2,计算时要注意电子守恒的应用。
(3)浓H2SO4与Cu反应之生成SO2,随着反应进行,浓H2SO4变稀,Cu与稀H2SO4不反应,因此足量的Cu与浓H2SO4反应,产生的SO2的物质的量要小于浓H2SO4的一半。
【例题3】(2011年海南高考)铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为_______;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_____;该晶体中,原子之间的作用力是_____;
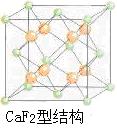
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为______。
解析:本题各小题内容考查点相互的联系不大,仍属于“拼盘”式题。(3)硫酸根中心原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;(4)Au电子排布或类比Cu,只是电子层多两层,由于是面心立方,晶胞n(Cu)=6×1/2=3n(Au)=8×1/8=1;(5)CaF2结构如下图所示,所以氢原子在晶胞内有4个,可得储氢后的化学式为H8AuCu3
答案:(1)Cu+2 H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O;
CuSO4+SO2↑+ 2H2O;
(2)白色无水硫酸铜可与水结合生成蓝色的CuSO4·5 H2O,显示水合铜离子特征蓝色;
(3)正四面体,sp3;(4)6s1;(5)3:1;(4)金属键;(5)H8AuCu3
点拨:由于《物质结构与性质》模块近年才在在高考中出现,不可能出很难的题,且结构与性质之间的关系的紧密联系也不能体现过深,因而目前的高考来看,试题只能是拼盘式的。学习过程中有一定的难度,几个考点除配位外,基本在本题中都考到,与近几年的考题变化不大。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
钛(化学符号 Ti,原子序数 22)是一种具有优异综合性能的过渡...
关于亚铁离子与铁氰化钾的反应,简单来说,其核心产物是一种...
新型合金是指通过成分优化、微观结构调控、制备工艺创新形成...
纯净的铁块是银白色的,而铁粉是黑色的。这并非因为铁本身发...
1. 为什么大块的铁(或铁制品)是银白色的? 这主要归功于金属...
一、汞齐——汞是金属溶剂 1、汞齐,是一种汞与几种其他金属...