
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、历史文化中的铜
1.铜在历史上曾广泛用于制造货币,原因是铜的熔点较低,容易冶炼铸造成型,化学性质稳定,不易被腐蚀,且有迷人的光泽等。
2.青铜与纯铜相比,青铜的硬度大,熔点低,耐腐蚀。
3.斑铜制作技艺是在铜中掺杂金、银等金属,斑铜的熔点比纯铜低。
4.宋代《千里江山图》,其中绿色来自孔雀石颜料[主要成分为Cu(OH)2·CuCO3],青色来自蓝铜矿颜料[主要成分为Cu(OH)2·2CuCO3]。孔雀石、蓝铜矿颜料的主要成分均可与酸反应生成相应的铜盐,因此,用其制作的颜料不耐酸腐蚀。
二、物质结构中的铜
1.铜的原子结构与性质
(1)铜元素的原子序数为 29,位于元素周期表中第 4周期第ⅠB族,属于ds区元素,最外层有 1个电子,常见化合价有 +1、+2价。
(2)铜元素基态原子的电子排布式为1s22s22p63s23p63d104s1。
铜元素基态原子的简化电子排布式为[Ar]3d104s1。
铜元素基态原子的价层电子轨道表示式为:
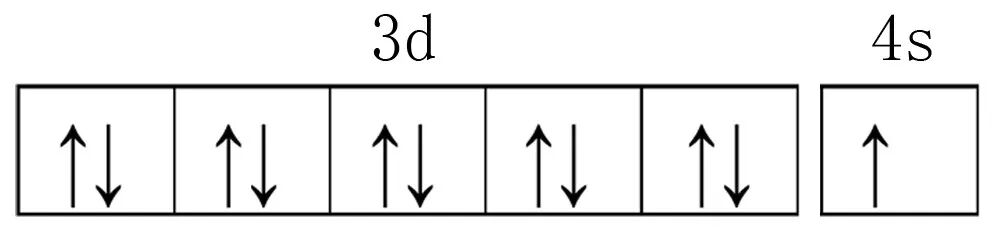
(3)Cu具有良好的导电性,从金属键的理论看,原因是金属晶体中的自由电子可在外加电场作用下发生定向移动。
2.铜晶体结构
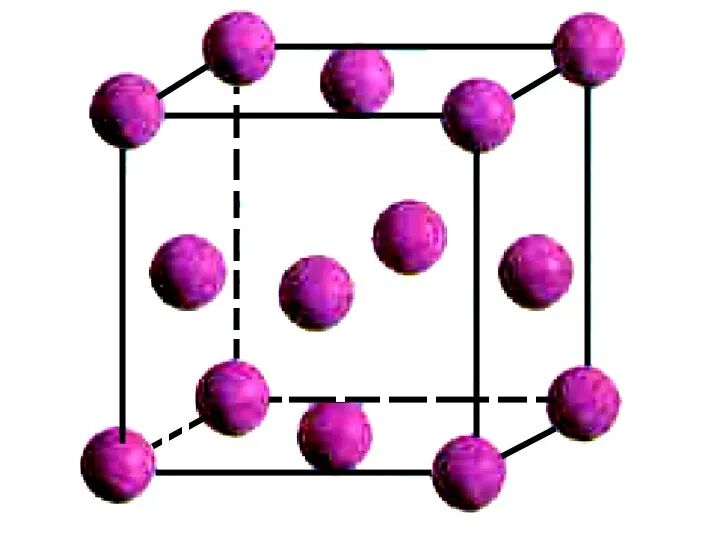
(1)[人教版选必2第73页]图1是金属铜的一个晶胞,它是一个立方体。
①该晶胞中含有的铜原子个数: 8× 1 8 +6× 1 2 =4
②若铜晶胞的边长为a nm, 可计算铜的密度。
取1 mol 该晶胞,晶胞质量为64 g/mol×4 mol=256 g, 总体积为a3×10-21NA cm3,则铜的密度 ρ= 256 a 3 ×10 -21 ΝA g/cm 3
3.铜离子的配合物
(1)[人教版选必2第96页][Cu(NH3)4]2+在实验室中制备方法如下:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液。
①依次发生反应的离子方程式为:
CuSO4 + 2NH3·H2O === Cu(OH)2↓ + (NH4)2SO4
Cu(OH)2↓ + 4NH3=== [Cu(NH3)4](OH)2
②[Cu(NH3)4]2+的结构可用示意图表示为:
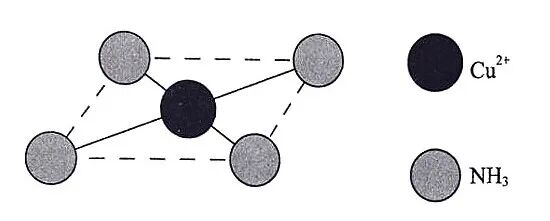
③[Cu(NH3)4]2+具有对称的空间结构,若其中2个NH3被2个Cl-取代,能得到2种不同结构的产物,则该配离子的空间构型为平面正方形。[Cu(NH3)4]2+中Cu2+以Dsp2杂化轨道成键。
(2)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可表示为:
(3)胆矾(CuSO4·5H2O)可写成:[Cu(H2O)4]SO4·H2O,其结构如图2所示。
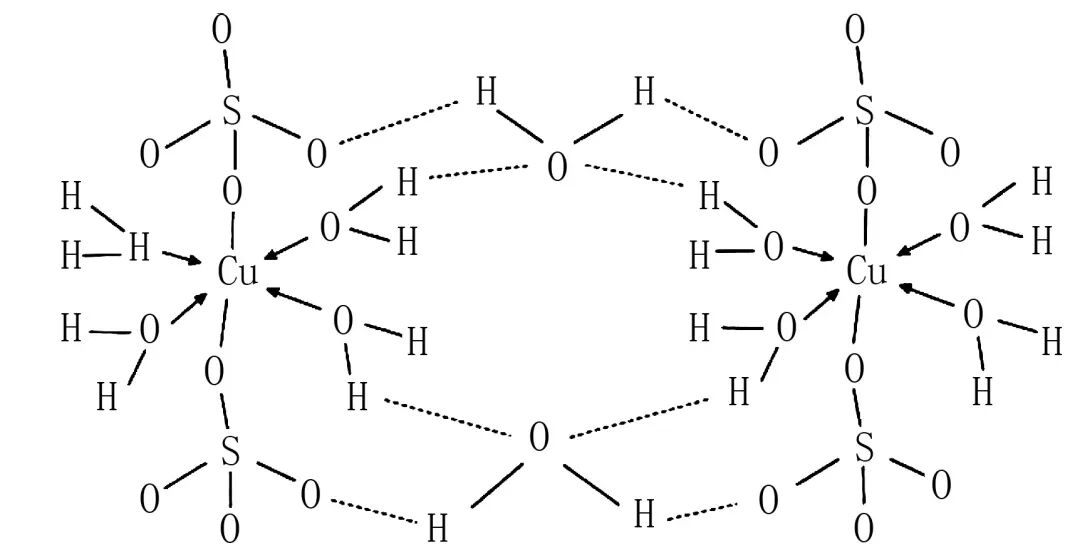
① 该配合物的中心离子是Cu2+,其价电子排布式为3d9。
②CuSO4·5H2O中,有4个H2O和Cu2+配位,1个H2O以氢键和SO42- 及2个配位H2O结合。温度升高,逐步脱水。
③1 mol [Cu(H2O)4]2+中配位键的数目为4NA。
④1 mol [Cu(H2O)4] SO4·H2O中σ键数目为18NA。
⑤已知NF3与NH3的空间结构相同,但NF3不易与Cu2+形成配离子,其原因是N、F、H 3种元素的电负性由强到弱的顺序为F>N>H,在NF3中,共用电子对偏向氟原子,偏离氮原子,使得氮原子上的孤电子对难与Cu2+形成配位键。
三、化学反应原理中的铜
1.化学平衡移动原理中的铜
(1)金属铜可与氨水和过氧化氢的混合溶液反应,其原因是过氧化氢为氧化剂,氨与Cu2+形成 [Cu(NH3)4]2+,两者相互促进使反应进行。反应为:
(2)在CuCl2溶液中存在如下平衡:

加热盛有CuCl2溶液的试管,平衡正向移动,溶液变为黄绿色;然后将试管置于冷水中冷却,溶液变为蓝绿色。
(3)向CuSO4溶液中加入固体NaCl, 溶液由浅蓝色变为黄绿色,发生反应的离子方程式为:
2.盐类水解中的铜
(1)CuSO4溶液呈酸性,原因是:
该溶液中,各离子浓度由大到小顺序为c(SO42- )>c(Cu2+)>c(H+)>c(OH-)。
(2)为除去硫酸铜溶液中混有的硫酸铁,可向该溶液中加入CuO、Cu(OH)2、Cu2(OH)2CO3或CuCO3等调pH,沉淀,过滤,除去氢氧化铁,得到较纯净的硫酸铜溶液。
(3)加热CuCl2·2H2O晶体制取无水氯化铜,需在HCl气氛中进行,以防止CuCl2水解。
3.沉淀转化中的铜
在自然界发生着溶解度小的矿物转化为溶解度更小的矿物的现象。
已知:Ksp(PbS)=8.0×10-28,Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.3×10-36。
自然界中CuSO4生成铜蓝的反应为:
CuSO4(aq)+PbS (s) = CuS(s)+ΡbSΟ4(s)
4.电解精炼铜
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯。以CuSO4溶液为电解质溶液,粗铜接电源正极,发生氧化反应,纯铜接电源负极,发生还原反应。
阳极: Cu-2e- = Cu 2+ (主反应)
阴极: Cu 2+ +2e- = Cu
电解后,利用阳极泥可回收Ag、Pt等金属。
(1)电解液中增加Zn2+、Fe2+等 ,CuSO4溶液浓度变小。
(2)阳极质量减少不等于阴极质量的增加。
四、有机化学中的铜
1.在试管里加入2 mL10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL 乙醛溶液,加热,产生砖红色沉淀。
2.在试管里加入2 mL10% NaOH溶液,加入5滴5% CuSO4溶液,得到新制的Cu(OH)2,再加入2 mL 10%葡萄糖溶液,可观察到绛蓝色的澄清溶液,这是因为多羟基有机化合物遇到新制Cu(OH)2会形成绛蓝色配合物;加热,产生砖红色沉淀。证明葡萄糖是一种多羟基醛。
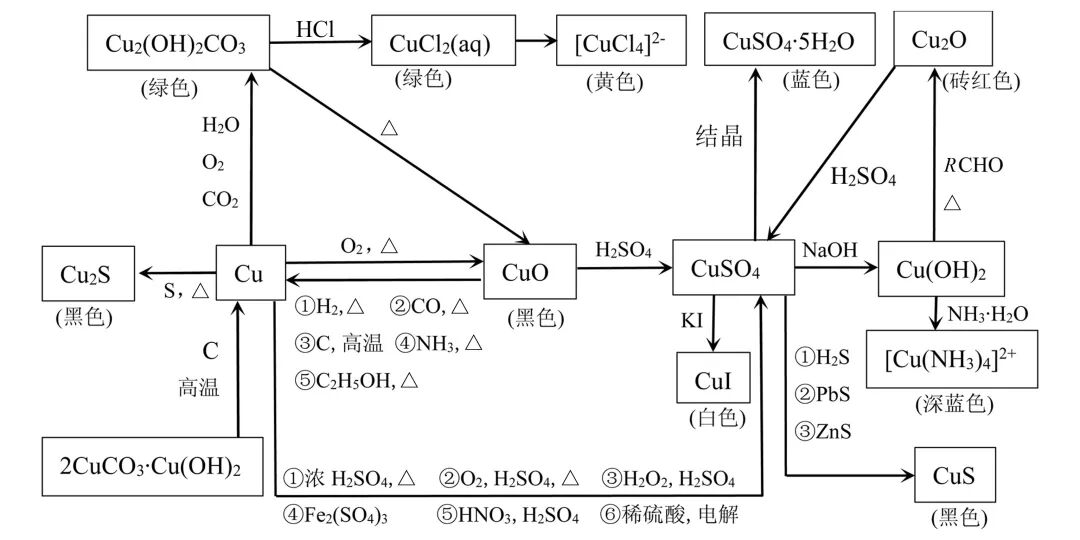
五、铜及其化合物之间的转化
铜及其化合物之间的转化如图3所示。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、历史文化中的铜 1.铜在历史上曾广泛用于制造货币,原因是...
一、单质铁 1、铁元素的存在 (1)游离态: 存在于 陨铁 中 (...
...
...
...
...