
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、分子的立体结构
多原子的分子中原子的空间关系,称为“分子的立体结构“
常见分子的立体结构,见表:
分子空间构型 | 实 例 | 结构式 | |
五原子分子
| 109°28′ | CH4 (正四面体形) |
|
四原子分子
| 60° | 白磷:P4(正四面体形) |
|
120° | CH2O ( 平面三角形)
|
| |
107° | NH3 三角锥形 |
| |
三原子分子
| 105° | H2O V(折线型)
|
|
180° | CO2 |
|
二、价电子对互斥模型预测分子立体结构的基本方法
1.中心原子上的价电子都用于形成共价键,它们的立体结构可用中心原子周围的原子数n来预测:
ABn | 立体结构 | 示例 |
n=2 | 直线形 | CO2 |
n=3 | 平面三角形 | CH2O ,BF3等 |
n=4 | 正四面体形 | CH4 |
2.中心原子上有孤对电子(未用于形成共价键的电子对)的分子,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,如H2O有2对孤对电子,互相排斥,结构为V(折线型),NH3 有1对孤对电子,互相排斥结构,结构为三角锥形。
三、杂化轨道类型
掌握分子空间构型与杂化类型的关系
(1)sp杂化—直线型
是由一个ns轨道和一个np轨道杂化而成的两个轨道,轨道间的夹角为180℃,是直线型。如BeCl2
(2)sp2杂化—平面三角型
是由一个ns轨道和两个np轨道杂化而成的三个轨道,轨道间的夹角为120℃,是平面三角型。如BF3
(3)sp3杂化—四面体型
是由一个ns轨道和三个np轨道杂化而成的四个轨道,轨道间的夹角为109.5℃,是四面体型。如CH4
原子间要形成共价键,它们的价电子中应当有未成对的电子(记住短周期元素的价电子排布);杂化轨道上的电子更易与其它原子的原子轨道上的电子形成共价键;杂化轨道的能量相同,杂化后电子排布符合洪特规则。
解题时,可以根据构型反推中心原子杂化类型,注意sp3杂化后如果存在孤对电子,受孤对电子的排斥作用,空间结构发生变化,为三角锥型;可以根据分子式中非中心原子的数目与成键所需要的电子数(未成对电子数),结合中心原子的价电子数,进行分析确定杂化类型;有机化合物中:饱和碳原子是sp3杂化,双键碳原子是sp2杂化,叁键碳原子是sp杂化。
四、配位键的特征
电子对给予——接受键,称为配位键。
1.孤对电子
分子或离子中没有跟其他原子共用的电子对称孤对电子。
2.配位键
电子对是由一个原子单方面提供而跟另一原子共用,形成的一种新的化学键叫配位键。
3.配位键的形成
一方(如A)是能够提供孤对电子的原子,另一方(如B)是具有接受孤对电子的空轨道的原子,表示为A→B。如配合物:硫酸四氨合铜,化学式为[Cu(NH3)4]SO4称为配位化合物(简称配合物),[Cu(NH3)4]2+称为络离子(四氨合铜离子),Cu2+有空轨道,NH3有孤对电子,则Cu2+与NH3形成配位键,且配位键的数目为4,表示为
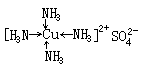 。
。
附:含有孤对电子的微粒有:分子如CO、NH3、H2O等;离子如Cl—、CN—、NO2—等。含有空轨道的微粒有:过渡金属的原子或离子。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
NH4+的形成
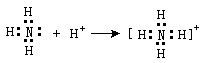 ,
,
在NH4+中,虽然有一个N-H键形成过程与其它3个N-H键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
分子的性质
1.极性分子和非极性分子特征
极性分子的特征:正电中心和负电中心不重合,使分子的某一部分呈正电性(δ—),另一部分呈负电性(δ+),非极性分子的特征:正电中心和负电中心重合。
评注:根据形成共价键的原子所带电荷的状况划分为:极性键和非极性键。能够判断哪些共价键是极性键、哪些共价键是非极性键。明确共价键的极性和分子极性的关系,分子的极性是分子中化学键的极性的向量和,只含非极性键的双原子分子一定是非极性分子;含有极性键的分子:若极性键的极性的向量和等于零时,为非极性分子;否则是极性分子。如CH4、CO2等含有极性键,是极性分子;H2O、NH3等含有极性键,是极性分子。
2.范德华力
概念:分子与分子之间的作用力。
规律:相对分子质量越大,范德华力越大;分子的极性越大,范德华力也越大;结构相似的物质,相对分子质量越大,范德华力越大,则沸点升高。
3.氢键
氢键表示:X—H…Y,X、Y主要是N、O、F三种元素,氢键的形成主要表现为物质的熔点、沸点升高。氢键可存在分子之间,也存在分子内之内,氢键大小介于范德华力和化学键之间,不属于化学键。
4.相似相溶经验规律
非极性溶质一般能溶于非极性溶剂;极性溶质一般能溶于极性溶剂。若溶质与溶剂能形成氢键,溶解性越好。
5.手性分子
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。有手性异构体的分子叫做手性分子。
6.无机含有酸分子的酸性
规律:同一种元素形成的含氧酸,非羟基氧原子数越多,酸性越强。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的, CuBr 2 固体是深褐...
键的极性和分子的极性会物质的物理性质和化学性质。 一、共价键的极性 1 、键的极性和...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨道很有用) 1 、共价键是...
一、 共价键 非金属元素原子之间以共用电子对形式形成的化学键叫做共价键。它具有饱和...
氢键 :像 H 2 O 、 NH 3 、 HF 这样的分子之间存在着一种比分子间作用力稍强的相互作...
...