
|
学习小专题 |
 在水溶液中K值大于1为强酸
日期:2022-08-06 17:08:15
点击:7457
好评:0
在水溶液中K值大于1为强酸
日期:2022-08-06 17:08:15
点击:7457
好评:0
HI 10 11 HBr 10 9 HCl 10 7 HClO 4 10 7 HClO 3 10 3 H 2 SO 4 10 2 HNO 3 20 H 3 O + 1 C 2 H 2 O 4 (草酸 ) 5.4*10 -2 HSO 4 - 10 -2 H 3 PO 4 6.7*10 -3 [Fe(H 2 O) 6 ] 2+ 7.7*10 -3 HNO 2 6.0*10 -4 HCOOH 1.8*10 -4 HN 3 2.4*10 -5 CH 3 COOH 1.8*10 -5 H 2 CO 3...
 常见酸的酸性强弱的判断
日期:2021-12-14 15:14:02
点击:25641
好评:5
常见酸的酸性强弱的判断
日期:2021-12-14 15:14:02
点击:25641
好评:5
(1)含氧酸的酸性强弱的判断: ①不同元素的最高价含氧酸,元素的非金属性越强,酸性越强, 如 ②同种元素的不同价态的含氧酸,元素的化合价越高,酸性越强 氧化性: 酸性: (2)无氧酸(气态氢化物水溶液)酸性强弱的判断: ①同一主族元素,半径越大,氢化物酸性越...
 高中常见酸的强弱比较
日期:2019-11-13 15:05:28
点击:18988
好评:8
高中常见酸的强弱比较
日期:2019-11-13 15:05:28
点击:18988
好评:8
本文所说的酸性强弱仅针对于高中的酸碱理论,(除此之外,在高中出现的习题中已经对酸碱质子理论有了一定的渗透。)酸性的强弱是根据酸电离出氢离子的能力来衡量的。不同的溶剂对酸碱的电离的影响不同。例如:HCl、HI、硫酸、硝酸、高氯酸等强酸,在水中100%电离,而在...
 无机酸酸性强弱比较
日期:2019-11-13 15:00:32
点击:26110
好评:0
无机酸酸性强弱比较
日期:2019-11-13 15:00:32
点击:26110
好评:0
一、含氧酸酸性强弱变化规律 若用通式HxROy表示含氧酸,则其酸性强弱与R元素的非金属性及其原子的半径有关。R元素的非金属性越强,则其原子核对核外共用电子对的吸引力越强,R-O 间的共用电子对越偏向R原子的一方;R元素原子的半径越小,则R-O间的共用电子对也越偏向R原...
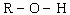 浅谈无机酸酸性强弱的变化规律
日期:2019-09-29 09:51:05
点击:28125
好评:0
浅谈无机酸酸性强弱的变化规律
日期:2019-09-29 09:51:05
点击:28125
好评:0
一、含氧酸酸性强弱变化规律 若用通式 表示含氧酸,则其酸性强弱与R元素的非金属性及其原子的半径有关。R元素的非金属性越强,则其原子核对核外共用电子对的吸引力越强, 间的共用电子对越偏向R原子的一方;R元素原子的半径越小,则 间的共用电子对也越偏向R原子一方,...
 最高价氧化物的水化物酸碱性强弱解释
日期:2016-03-22 10:35:49
点击:1853
好评:0
最高价氧化物的水化物酸碱性强弱解释
日期:2016-03-22 10:35:49
点击:1853
好评:0
...
 弱酸的酸性强弱顺序
日期:2016-02-02 21:33:44
点击:15555
好评:3
弱酸的酸性强弱顺序
日期:2016-02-02 21:33:44
点击:15555
好评:3
顺口溜:亚硫磷酸氢氟酸,亚硝酸 ,甲酸苯甲冰醋酸,碳酸氢硫次氯酸,氰氢后面是苯酚。即H 2 SO 3 H 3 PO 4 HFHNO 2 HCOOH苯甲酸CH 3 COOHH 2 CO 3 H 2 S次氯酸HCN 苯酚,其他常见酸如HClO 4 , H 2 SO 4 ,HNO 3 ,HI,HBr都是强酸,强酸在水里视作酸性等同。 碱性:Fe(OH...
 弱酸酸性强弱顺序及应用举例
日期:2016-02-02 10:12:01
点击:2097
好评:0
弱酸酸性强弱顺序及应用举例
日期:2016-02-02 10:12:01
点击:2097
好评:0
...
 如何证明硬脂酸具有酸性?
日期:2015-02-12 19:30:16
点击:1928
好评:0
如何证明硬脂酸具有酸性?
日期:2015-02-12 19:30:16
点击:1928
好评:0
要证明硬脂酸具有酸性,可采取的正确实验是【 】 A.把硬脂酸溶于汽油,加入石蕊试液,溶液变红 B.把纯碱加入硬脂酸并微热,发生泡沫 C.把硬脂酸加热熔化,加入金属钠,产生气泡 D.把稀烧碱溶液加入硬脂酸并滴入几滴酚酞溶液,微热.红色变浅或消失 【解析】 硬脂酸...
 为什么磷酸、硫酸、高氯酸的酸性依次增强?
日期:2012-12-03 10:39:43
点击:13850
好评:0
为什么磷酸、硫酸、高氯酸的酸性依次增强?
日期:2012-12-03 10:39:43
点击:13850
好评:0
为什么H 3 PO 4 ,H 2 SO 4 ,HClO 4 的酸性依次增强,据三种酸的结构: 不难看出,随着最外层电子数的增多,配位键的共用电子对也增多,依次为1对,2对,3对。由于形成配位键的电子对偏向氧的一方,而使氧带负电荷,磷、硫、氯带正电荷,从而增加了磷、硫、氯从-O-H基吸...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。