
|
学习小专题 |
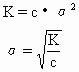 溶液浓度、离子浓度、电离度及电离常数的相互关系
日期:2018-01-24 16:46:40
点击:10544
好评:0
溶液浓度、离子浓度、电离度及电离常数的相互关系
日期:2018-01-24 16:46:40
点击:10544
好评:0
之一 在一元弱酸、弱碱的稀溶液中,弱酸或弱碱的原浓度、离子浓度、电离常数、电离度之间的关系 K—电离常数 α—电离度 c—电解质原浓度 之二...
 弱电解质电离度α与电离平衡常数K的关系
日期:2016-02-02 20:00:27
点击:18446
好评:2
弱电解质电离度α与电离平衡常数K的关系
日期:2016-02-02 20:00:27
点击:18446
好评:2
问题:醋酸在水中电离后的电离平衡常数为K,加入盐酸,氢离子浓度增加了,醋酸电离平衡逆向移动,使得醋酸电离程度改变,但是为什么加入盐酸前后醋酸的电离平衡常数不变?电离平衡常数不是表示电离程度吗? 分析: 1、逆向移动使得醋酸电离程度改变 这句话是对的 因为电...
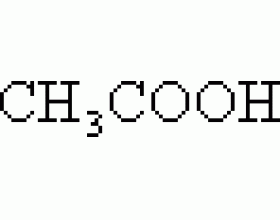 电离度解析
日期:2013-04-10 08:32:20
点击:5143
好评:0
电离度解析
日期:2013-04-10 08:32:20
点击:5143
好评:0
弱酸、弱碱等弱电解质在水溶液中存在电离平衡。例如: 当达到电离平衡时,弱电解质溶液里的离子浓度保持一定,可用此时离子浓度的高低衡量弱电解质的相对强弱。本节的电离度就是定量描述弱电解质强弱的重要概念。 1 .准确理解电离度的概念 当弱电解质在溶液里达到电离平衡...
 影响电离度的因素
日期:2012-05-16 09:19:41
点击:12092
好评:0
影响电离度的因素
日期:2012-05-16 09:19:41
点击:12092
好评:0
①电解质的结构 具有离子键或强极性的分子在水溶液中的电离度均很大,几乎是100%。弱极性或非极性分子在水中呈微弱电离甚至不电离。电解质中键的极性越大,其电离度也越大。离子化合物的电离度取决于离子电荷及离子半径。离子电荷越高,半径越小,则其电离度越...
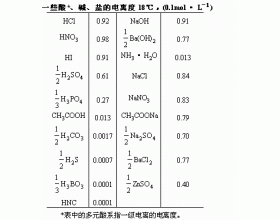 强电解质的表观电离度
日期:2012-05-16 09:16:58
点击:5223
好评:0
强电解质的表观电离度
日期:2012-05-16 09:16:58
点击:5223
好评:0
强电解质在水溶液中是完全电离的,原则上不存在电离度。但由于离子间存在静电引力的作用,导致它们在宏观上表现出不完全电离,而存在一定的电离度,把强电解质的电离度称做表观电离度。因此,强电解质的电离度也小于1(见表)。...
 电离常数和电离度有什么关系?
日期:2012-05-16 08:41:29
点击:40062
好评:0
电离常数和电离度有什么关系?
日期:2012-05-16 08:41:29
点击:40062
好评:0
(1)弱电解质的电离是一种可逆过程。以醋酸的电离为例,醋酸溶于水后,它的分子即电离为H+离子和CH 3 COO - 离子,这是正过程,同时逆过程是H + 离子和CH 3 COO - 离子重新结合成醋酸分子。 CH 3 COOH H + +CH 3 COO - 在这个过程中,CH 3 COOH分子电离的速率(正反应的速率)...
 纯水的电离度是多大?
日期:2012-05-15 18:26:17
点击:7758
好评:0
纯水的电离度是多大?
日期:2012-05-15 18:26:17
点击:7758
好评:0
生活中,我们一般会认为纯水是不导电的。但根据精确的实验证明,水是一种极弱的电解质,它能微弱地电离,生成水合氢离子和氢氧根离子。其电离方程式可表示为: H 2 O+H 2 O H 3 O + +OH - 可简写为:H 2 O H + +OH - ,从纯水的导电实验测得,在25℃(常温)时,纯水中H + 和...
 电离度
日期:2007-09-11 13:58:15
点击:7995
好评:0
电离度
日期:2007-09-11 13:58:15
点击:7995
好评:0
弱酸、弱碱等弱电解质在水溶液中存在电离平衡。例如: 当达到电离平衡时,弱电解质溶液里的离子浓度保持一定,可用此时离子浓度的高低衡量弱电解质的相对强弱。本节的电离度就是定量描述弱电解质强弱的重要概念。 1 .准确理解电离度的概念 当弱电解质在溶液里达到电离...
 关于“弱电解质溶液越稀,电离程度越大”的几种解释方法
日期:2007-05-14 14:32:18
点击:11726
好评:0
关于“弱电解质溶液越稀,电离程度越大”的几种解释方法
日期:2007-05-14 14:32:18
点击:11726
好评:0
1 .用有效碰撞理论解释 在其他条件不变的情况下,向一定浓度的弱电解质溶液中加水,由于水分子数增多,使得弱电解质电离的离子之间的距离增大,离子间相互碰撞结合成分子的机会减小,单位时间内离子间的有效碰撞次数减少。另外,弱电解质分子由于受到极性分子的作用,...
 弱酸碱稀释时的电离度与离子浓度
日期:2006-10-15 08:01:52
点击:6529
好评:2
弱酸碱稀释时的电离度与离子浓度
日期:2006-10-15 08:01:52
点击:6529
好评:2
1.一元弱酸稀释时的电离度与H+离子浓度 以醋酸为例加以说明。 无水冰醋酸基本不电离,其电离度可视为零,冰醋酸中也没有离子,只有CH3COOH分子。 当对冰醋酸加水稀释时,随着水量的增加,醋酸的电离度增大,[H+]也增大,所含H+物质的量也增大。但当加水到一定量时,即...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。