
|
学习小专题 |
 亚铁离子的核外电子排布式究竟是哪种?
日期:2021-12-28 08:44:41
点击:17324
好评:0
亚铁离子的核外电子排布式究竟是哪种?
日期:2021-12-28 08:44:41
点击:17324
好评:0
最近在网上看到两种不同的亚铁离子核外电子排布式: 一种认为:由于铁的电子排布式为[Ar]3d 6 4s 2 ,4s为最外层,两个电子容易失去,故亚铁离子的核外电子排布式应该为[Ar]3d 6 ; 另一种认为:由于铁的电子排布式为[Ar]3d 6 4s 2 ,当失去第一个4s电子后,4s轨道还有...
1. 排布原则 1) 能量最低原理 电子由能量低的轨道向能量高的轨道排布(电子先填充能量低的轨道,后填充能量高的轨道. 2) Pauli(保利)不相容原理 每个原子轨道中只能容纳两个自旋方向相反的电子(即同一原子中没有运动状态完全相同的电子,亦即无四个量子数完全相同的电子). ...
 微课视频之酷学习:构造原理和电子排布式
日期:2020-03-03 14:28:16
点击:245
好评:0
微课视频之酷学习:构造原理和电子排布式
日期:2020-03-03 14:28:16
点击:245
好评:0
第1集:构造原理和电子排布式...
 微课视频:电子排布式的书写方法及注意事项
日期:2019-04-09 16:40:35
点击:564
好评:0
微课视频:电子排布式的书写方法及注意事项
日期:2019-04-09 16:40:35
点击:564
好评:0
微课视频:电子排布式的书写方法及注意事项。...
 电子排布式、电子排布图、原子结构示意图比较大全
日期:2017-08-17 08:19:21
点击:1506
好评:0
电子排布式、电子排布图、原子结构示意图比较大全
日期:2017-08-17 08:19:21
点击:1506
好评:0
电子排布式、电子排布图、原子结构示意图比较大全.xls...
 例析离子核外电子排布式的书写
日期:2016-05-17 21:16:46
点击:6303
好评:0
例析离子核外电子排布式的书写
日期:2016-05-17 21:16:46
点击:6303
好评:0
核外电子排布式是贯穿《物质结构与性质》的一条主线,通过核外电子排布式可以很清楚地了解原子的结构,对于元素性质的研究有着重要的作用。人教版高中化学选修3《物质结构与性质》教材中,对于原子的核外电子排布式作了详细的讲解,但对于离子基态核外电子排布式并未作...
 电子排布式与外围电子排布式辨析
日期:2015-12-11 19:50:42
点击:10658
好评:0
电子排布式与外围电子排布式辨析
日期:2015-12-11 19:50:42
点击:10658
好评:0
主族元素: 最外层电子排布式=价电子排布式=外围电子排布式=特征电子构型 过渡元素: 价电子排布式=外围电子排布式=特征电子构型≠最外层电子排布式。即过渡元素不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子。 外围电子=成键电子+非成键电子 ...
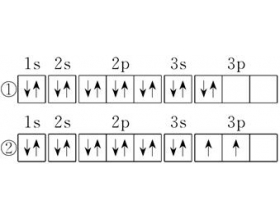 关于洪特规则的解释说明
日期:2014-09-14 21:09:56
点击:13123
好评:0
关于洪特规则的解释说明
日期:2014-09-14 21:09:56
点击:13123
好评:0
一.洪特规则的定义 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。 根据洪特规则的定义,①不符合洪特规则,①中3P能级里的2个电子应该优先单独占据一个轨道,而且自旋状态相同。②符合洪特规则的规定。 二.洪特规则的...
 电子排布式书写注意事项
日期:2014-06-25 23:06:43
点击:4832
好评:0
电子排布式书写注意事项
日期:2014-06-25 23:06:43
点击:4832
好评:0
根据 Pauling 原子轨道能级图和电子填充三原则, 将原子或离子的电子排布书写出来. 但在书写时, 要注意: (1)电子填充是按近似能级图自能量低向能量高的轨道排布填充的, 是为了是原子整体能量最低。但书写电子结构式时, 按方便与习惯,要把同一主层(n相同)的轨道写在一...
 元素基态电子排布式
日期:2013-04-09 10:10:27
点击:19242
好评:0
元素基态电子排布式
日期:2013-04-09 10:10:27
点击:19242
好评:0
原子序数 元素 电子构型 原子序数 元素 电子构型 原子序数 元素 电子构型 1 H 1s 1 38 Sr [Kr]5s 2 75 Re [Xe]4f 14 5d 5 6s 2 2 He 1s 2 39 Y [Kr]4d 1 5s 2 76 Os [Xe]4f 14 5d 6 6s 2 3 Li [He]2s 1 40 Zr [Kr]4d 2 5s 2 77 Ir [Xe]4f 14 5d 7 6s 2 4 Be [He]2s 2 41...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。