
|
学习小专题 |

|
学习小专题 |
 [方法与规律h] 反应热计算方法 作者:化学自习室 来源:未知 日期:2020-04-26 19:59:17 点击:2476 所属专题:反应热计算
[方法与规律h] 反应热计算方法 作者:化学自习室 来源:未知 日期:2020-04-26 19:59:17 点击:2476 所属专题:反应热计算
一、比例法 热量的求算:化学计量数与△H绝对值成正比 例10.3mol的气态高能燃料乙硼烷( )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,写出其热化学方程式_______________________。解析:根据书写热化学方程式的要求,写出热化学方程式并配平: 可列...
 [方法与规律h] 突破内能、键能、活化能与能量图像分析 作者:化学自习室 来源:未知 日期:2020-02-21 12:13:32 点击:91311 所属专题:反应能量图像
[方法与规律h] 突破内能、键能、活化能与能量图像分析 作者:化学自习室 来源:未知 日期:2020-02-21 12:13:32 点击:91311 所属专题:反应能量图像
一、内能的含义 1、微观定义 从微观上说,系统内能是构成系统的所有分子无规则运动动能、分子间相互作用势能、分子内部以及原子核内部各种形式能量的总和。后面两项在大多物理过程中不变,因此一般只需要考虑前两项,二者的总和就是通常所指的内能。但在涉及电子的激发、电...
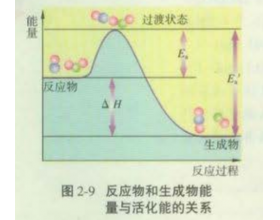 [方法与规律h] 高考题中催化剂与反应历程图的考查(能垒) 作者:张劲辉 来源:未知 日期:2024-04-26 08:11:16 点击:37035 所属专题:反应能量图像 催化剂原理及应用 能垒
[方法与规律h] 高考题中催化剂与反应历程图的考查(能垒) 作者:张劲辉 来源:未知 日期:2024-04-26 08:11:16 点击:37035 所属专题:反应能量图像 催化剂原理及应用 能垒
2017年高考化学考试说明中特别增加了一条:了解反应活化能的概念,了解催化剂的重要作用。2018年的与2017年一样,没有改变,2019年也没有变化。 高考题中通过反应历程图考查催化剂是一个什么的演变过程,下面通过一系列的高考题就可以看出一点端倪。 一、题源——教材中...
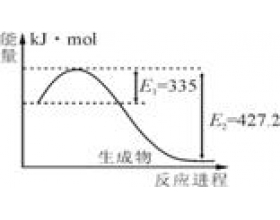 [方法与规律h] 化学反应热计算的几种方法介绍 作者:化学自习室 来源:未知 日期:2018-10-08 20:55:45 点击:20565 所属专题:反应热计算
[方法与规律h] 化学反应热计算的几种方法介绍 作者:化学自习室 来源:未知 日期:2018-10-08 20:55:45 点击:20565 所属专题:反应热计算
(一)根据热化学方程式计算 若题目给出了相应的热化学方程式,其计算方法与根据一般方程式相似,可以把Δ H 看成方程式内的一项进行处理,反应热与反应物中各物质的物质的量成正比;若没有给出热化学方程式,则根据条件先写出热化学方程式,再计算反应热。 例1.卫星发射...
 [方法与规律z] 解答能量变化图像题的四关键 作者:范瑞开 来源:未知 日期:2017-04-08 18:58:22 点击:968 所属专题:反应能量图像
[方法与规律z] 解答能量变化图像题的四关键 作者:范瑞开 来源:未知 日期:2017-04-08 18:58:22 点击:968 所属专题:反应能量图像
...
 [方法与规律h] 反应热图像试题归类分析 作者:陈万 来源:未知 日期:2016-03-05 16:38:21 点击:1497 所属专题:反应能量图像
[方法与规律h] 反应热图像试题归类分析 作者:陈万 来源:未知 日期:2016-03-05 16:38:21 点击:1497 所属专题:反应能量图像
...
 [方法与规律h] 热化学方程式及其书写 作者:陈恒 来源:未知 日期:2014-12-06 19:27:36 点击:2051 所属专题:热化学方程式
[方法与规律h] 热化学方程式及其书写 作者:陈恒 来源:未知 日期:2014-12-06 19:27:36 点击:2051 所属专题:热化学方程式
热化学方程式是表示化学反应中的物质变化和焓变。 一、热化学方程式的书写 与普通化学方程式相比,书写热化学方程式除了遵循书写普通化学方程式外,还应该注意以下几点: (1)反应热ΔH与测定的条件(温度、压强)有关,同一个化学反应,在不同温度或压强下进行时,所...
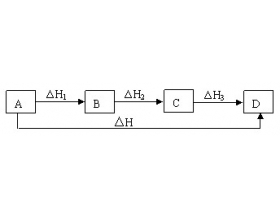
 [方法与规律h] 盖斯定律计算反应热的注意事项 作者:张瀚 来源:未知 日期:2018-10-08 20:56:11 点击:3562 所属专题:盖斯定律 反应热计算
[方法与规律h] 盖斯定律计算反应热的注意事项 作者:张瀚 来源:未知 日期:2018-10-08 20:56:11 点击:3562 所属专题:盖斯定律 反应热计算
化学反应的反应热只与始态和终态有关,而与反应途径无关,利用盖斯定律可以间接计算某些反应的反应热。 1.明确所求反应的始态和终态,各物质系数,及反应是吸热还是放热反应。 2.盖斯定律与反应途径无关,不同途径对应的最终结果是一样的。 3.各反应式相加时,有的反应...
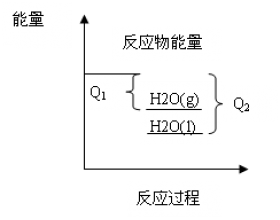 [方法与规律h] 例谈反应热大小比较的两种方法 作者:段文娟 来源:临沂市第十八中学 日期:2018-10-08 20:56:48 点击:4549 所属专题:反应热计算 盖斯定律
[方法与规律h] 例谈反应热大小比较的两种方法 作者:段文娟 来源:临沂市第十八中学 日期:2018-10-08 20:56:48 点击:4549 所属专题:反应热计算 盖斯定律
反应热大小比较是化学反应和能量变化这部分的常考题型,好多同学对这类题感觉无从下手,在这里介绍两种方法,希望能对读者起到帮助。 在这一章中经常会遇到这样的题: 在同温同压下,下列各组热化学方程式 Q 2 > Q 1 的是( ) A.2H 2 (g)+O 2 (g)=2H 2 O(g) ⊿H=- Q 1...
 [方法与规律h] 反应热计算七法 作者:吴键 来源:未知 日期:2018-10-08 20:58:33 点击:14148 所属专题:反应热计算
[方法与规律h] 反应热计算七法 作者:吴键 来源:未知 日期:2018-10-08 20:58:33 点击:14148 所属专题:反应热计算
一、比例法 热量的求算:化学计量数与△H绝对值成正比 例1 0.3mol的气态高能燃料乙硼烷( )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,写出其热化学方程式________________。 解析:根据书写热化学方程式的要求,写出热化学方程式并配平: 可列出等...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
1、2025 陕甘青宁 高温下MgCO 3 分解产生的MgO催化CO 2 与H 2 反应生...
1.基元反应 一个化学反应往往需要经过多个反应步骤才能实现...
一、热化学方程式的书写 与普通化学方程式相比,书写热化学方...
2017年高考化学考试说明中特别增加了一条:了解反应活化能的概...
方法技巧 解答能量变化图像题需要注意的几点。 (1)反应热不能...
对于“环式”反应过程图像可表示为: (1)位于“环上”的物质一...
一、定义 表示化学反应中吸收或放出的热量的化学方程式。 注...
盖 斯(Gormain Henri Hess l802-1850)1802年8月8日生于瑞士日内瓦市一...