1.如何判断一个反应是否是氧化还原反应?
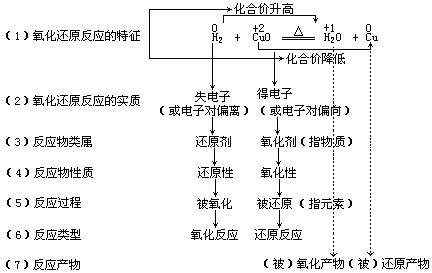
氧化还原反应的实质是元素间发生电子转移,其外部表现是元素的化合价发生了变化,因此我们可以根据元素的化合价是否改变来判断一个反应是不是氧化还原反应。
2.如何判断氧化还原反应中反应物的氧化性或还原性?
在发生氧化还原反应时,必然有电子的转移,化合价一定会改变。判断一种反应物是否具有氧化性,就要看这种物质在反应过程中,元素的化合价是否会降低。因此,凡是能得到电子,所含元素化合价降低的物质均具有氧化性。反之,在反应中易失电子,所含元素的化合价升高的物质具有还原性。
3.什么是氧化剂和还原剂
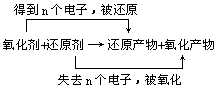
氧化剂是氧化还原反应里得到电子或有电子对偏向的物质。氧化剂从还原剂处得到电子自身被还原变成还原产物。氧化剂和还原剂是相互依存的,它们的关系如下式示:
氧化剂在反应里表现氧化性。氧化能力强弱是氧化剂得电子能力的强弱,不是得电子数目的多少,如浓硝酸的氧化能力比稀硝酸强,得到电子的数目却比稀硝酸少。含有容易得到电子的元素的物质常用作氧化剂,在分析具体反应时,常用元素化合价的升降进行判断:所含元素化合价降低的物质为氧化剂。
还原剂是在氧化还原反应里,失去电子或有电子对偏离的物质。还原剂失去电子自身被氧化变成氧化产物,如用氢气还原氧化铜的反应,氢气失去电子被氧化变成水。还原剂在反应里表现还原性。还原能力强弱是还原剂失电子能力的强弱,如钠原子失电子数目比铝电子少,钠原子的还原能力比铝原子强。含有容易失去电子的元素的物质常用作还原剂,在分析具体反应时,常用元素化合价的升降进行判断:所含元素化合价升高的物质为还原剂。
4. 氧化还原反应与四种基本类型反应的关系
①化合反应有单质参加的化合反应,是氧化还原反应,没有单质参加的化合反应,是非氧化还原反应。
②分解反应有单质生成的分解反应,是氧化还原反应,没有单质生成的分解反应,是非氧化还原反应。
③置换反应所有的置换反应都是氧化还原反应
④复分解反应都是非氧化还原反应
5.氧化还原反应的特征、实质
6..如何判断氧化剂和还原剂的强弱
判断氧化剂和还原剂的强弱时有以下规律:
①物质越易得电子或失电子,它们的氧化性或还原性越强。例如,非金属越活泼,得电子能力越强,则氧化性越强;金属越活泼,失电子能力越强,则还原性越强。注意,物质氧化性或还原性的强弱与它得失电子的多少无关。例如,钠原子在反应中失一个电子,镁原子在反应中失两个电子,但钠原子比镁原子易失电子,故钠的还原性强。
②强制弱规律——较强的氧化剂和较强的还原剂反应,生成较弱的还原剂和较弱的氧化剂。例如:H2S+I2=2HI+S
③不同的氧化剂与同一种还原剂反应时,还原剂失电子数越多,氧化剂的氧化性越强,例如:2Fe+3Cl2
说明氯气比硫的氧化性强。还原剂的还原性也可用类似方法判断,例如:
H2SO4(浓)+2HBr=SO2↑+Br2+2H2O
说明碘化氢比溴化氢还原性强。注意,物质氧化性或还原性的强弱,不能根据自身的还原或氧化的程度判断,例如:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
浓硝酸被还原为+4价,稀硝酸被还原成+2价,但浓硝酸比稀硝酸氧化性强。
上述反应分别说明,碘比硫氧化性强,硫化氢比碘化氢还原性强;Cl2比Fe3+氧化性强,Fe2+比Cl-还原性强。
④物质的氧化性或还原性的强弱还与温度、浓度、反应体系的酸碱性等因素有关。
⑤在溶液中,物质的氧化性或还原性可根据有关的标准电极电势及能斯特公式进行定量判断。
7. 判断氧化剂、还原剂强弱的依据
(1)氧化剂强弱判断依据:
①非金属单质的氧化性:非金属性越强,其单质氧化性越强,如F2>Cl2>Br2>I2>S
②金属阳离子的氧化性:金属活动性越强,其金属阳离子的氧化性越弱,反之,则越强。
按金属活动顺序表:Cu<(H)<Fe<Zn<Al<Mg<Na
对应阳离子氧化性:Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
③一般说来,同种元素,价态越高,氧化性越强
④同种氧化剂,一般说来,a.浓度越大,氧化性越强,如浓HNO3>稀HNO3,浓H2SO4>稀H2SO4
b.温度越高,氧化性越强,如:铜跟浓H2SO4只有加热才发生反应
(2)还原剂强弱的判断依据:
①金属单质的还原性:金属活动性越强,其单质还原性越强
如:Na>Mg>Al>Zn>Fe>Cu
②非金属阴离子的还原性:非金属性越强,其非金属阴离子的还原性越弱如HCl<HBr<HI<H2S
③一般说来,同种元素,价态越低,还原性越强
如H2S>S>SO2 Fe>Fe2+
基本规律:物质的氧化态氧化性越强、则对应的还原态的还原性就越弱;反之,则越强。
(责任编辑:化学自习室)


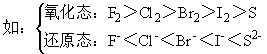
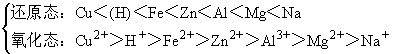

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。