
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、知识概述
(一)、内容及目的
1、离子反应的本质
2、离子反应发生的条件
3、离子方程式的书写方法
(二)、与前后的衔接关系
本节是在初中复分解反应发生的条件以及高中离子反应、氧化还原反应等基础上展开,从离子反应的本质出发,研究在什么条件下可使反应物的某些离子浓度减小,课本综合归纳了四种离子反应发生的条件,并对中学化学中常见的难溶物,难电离物质和挥发性物质等进行小结,使学生的知识系统化、网络化。
二、重点知识归纳及理解
(一)、离子反应
1、概念:有离子参加的化学的反应。
2、本质:反应物的某些离子浓度的减小。
3、类型
(1)离子互换的反应(即复分解反应):包括生成难溶物、易挥发性物质、难电离物质。
(2)有离子参加的氧化还原反应:有置换反应![]()
复杂的氧化还原反应![]()
(3)盐类的水解反应:这类离子反应方程式应区分为一般程度的水解和进行完全的水解,正确的使用“↓”、“↑”、“![]() ”、“=”。
”、“=”。
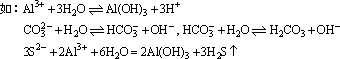
(4)络合反应:Fe3++3SCN-=Fe(SCN)3
此外,根据参加反应的微粒,离子反应又可分为离子与离子、离子与原子、离子与分子三类。
(二)、离子反应的书写
1、定义:用实际参加反应的离子符号来表示离子反应的式子。
2、离子方程式的书写步骤:四步。
“一写”:首先以客观事实为依据写出反应的化学方程式;
“二改”:把易溶于水、易电离物质改写成离子形式(最关键的一步):
“三删”:删去方程式两边未参加反应的离子;
“四查”:检查离子方程式两边各元素的原子个数和电荷总数是否相等。
3、离子方程式表示的意义:
离子方程式反映了离子反应的实质,它不仅能表示一定物质间的某个反应,而且可以表示同一类型的离子反应。
(三)、离子反应发生的条件
1、复分解型离子反应的条件
这类离子反应发生的条件与复分解反应的条件一致,分三种情况:
(1)生成难溶的物质
①常见的难溶物有:
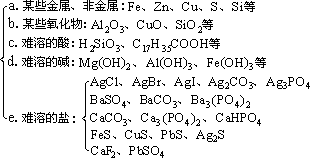
②当有关离子浓度足够大时,生成微溶物的反应也能发生,常见的微
溶物有CaSO4、Ag2SO4、MgCO3、Ca(OH)2等。
如:Ca2++SO42-=CaSO4↓
③由微溶物生成难溶物的反应也能发生,如:
Ca(OH)2+CO32-=CaCO3↓+2OH-
(微溶) (难溶)
CaSO4+CO32-=CaCO3↓+SO42-
(微溶) (难溶)
(2)生成难电离的物质
①常见的难电离的物质
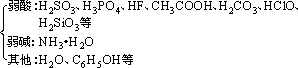
②反应规律:由强酸制弱酸,由强碱制弱碱。如:
盐酸+Ca(ClO)2溶液![]() H++ClO-=HClO
H++ClO-=HClO
稀醋酸+苯酚钠溶液![]() CH3COOH+C6H5O-=CH3COO-+C6H5OH
CH3COOH+C6H5O-=CH3COO-+C6H5OH
NH4Cl溶液+NaOH溶液![]() NH4++OH-=NH3·H2O
NH4++OH-=NH3·H2O
(3)生成挥发性物质
①常见的挥发性物质有:SO2、CO2、NH3、H2S等。
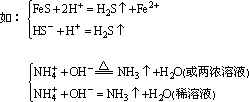
其中SO2、CO2、NH3即是挥发性物质,也是难电离物质(H2SO4、H2CO3、
NH3·H2O)进一步分解的产物,因此,从离子反应的本质上是相同的。
②有些离子反应不是电解质在电离的条件下进行的,不能用离子方程式表示。如:
实验室制NH3,用固态铵盐与固体Ca(OH)2反应:
![]()
实验室制HCl、HF、HNO3用浓硫酸与其盐反应:
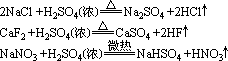
但Cu与浓H2SO4的反应不是离子反应。
2、有离子参与的氧化还原反应的条件
有些在溶液中进行的离子反应,是由于发生了氧化还原反应,使反应物的某些离子浓度减小。此类反应能否发生取决于有关离子的氧化性、还原性强弱,须满足由强变弱的原则,即由氧化性和还原性强的性质生成氧化性和还原性弱的物质。主要包括有离子参与的置换反应与其他有离子参与的氧化还原反应。如:
![]()
其他的离子反应,如盐类的水解、络合反应能发生的条件是反应物的某些离子结合成难电离的物质而引起反应物离子浓度的减小。
三、难点知识剖析
(一)、离子大量共存的规律
1、几种离子在同一溶液中,若离子之间不能发生反应,就能大量共存,否则不能大量共存。离子不能大量共存的原因从本质上说就是具备了离子反应发生的条件,主要分为以下四个方面:
(1)离子之间发生复分解反应
①生成难溶的物质
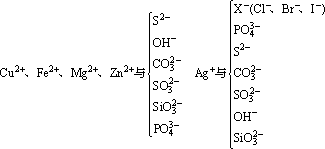
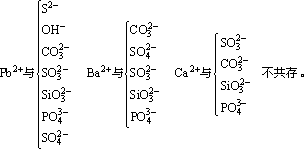
②生成易挥发的物质
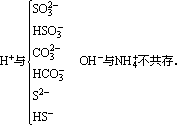
③生成难电离的物质
H+与OH-、CH3COO-、CN-、SiO32-、ClO-、PO43-不共存。
(2)离子间发生氧化还原反应
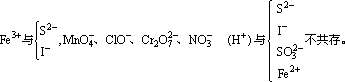
此外,在酸性条件下,S2O32-、SO32-与S2-、ClO-与Cl-、ClO3-与Cl-、MnO4-与Cl-都因发生氧化反应不能大量共存。
(3)离子间发生了双水解反应
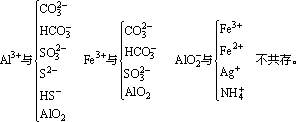
(4)络合反应:Fe3+与SCN-因发生络合反应不能大量共存。此外,还有以下四种情况应注意:
①弱酸的酸式酸根离子既不能与H+大量共存,又不能与OH-大量共存。
如:HS-+H+=H2S↑,HS-+OH-=S2-+H2O。
②能生成微溶物质的两种离子也不能大量共存。
如:Ca2+和SO42-,Ag+与SO42-,Ca2+与OH-。
③络离子与能破坏该离子的离子不能大量共存。
如:Ag(NH3)2++2H+=Ag++2NH4+
④H2PO4-与PO43-不能大量共存。
因为H2PO4-+PO43-=2HPO42-。
2、附加隐含条件的应用
(1)要抓住溶液特征:呈酸性、碱性还是中性,是否有颜色。常见有颜色的离子有:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnO4-(紫色)。
(2)对离子的限制条件:因发生氧化还原反应或加入某种物质不会产生气体或者沉淀而共存或不共存。
(3)题干中出现pH值、某指示剂变化,与Al反应放出I2等条件时,隐含着还要增加一种或几种离子。
(4)要看清要求是共存还是不共存。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、电解质、非电解质 01.电解质:在水溶液或熔融状态下能够导电的化合物。 02.非电...
1 、学会物质的构成方式 ( 1 )有些物质是由离子构成的。(多数金属化合物和铵盐:特...
判断离子方程式的正误是一种常考题型,其正误的判断可根据书写离子方程式的几个标准加...
离子反应是近年高考中的热点问题,几乎每年必考,主要以离子方程式正误判断以及离子共存...
...
...