
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
㈠ 立方晶型结构问题
⒈ 如果晶体中最小的重复单元(即晶胞)是立方体,则根据晶胞的组成和结构模型加以想象,可推断晶体组成微粒数目之比及晶胞中组成微粒个数。其计算思路如下:
⑴凡处于立方体顶点位置的微粒(简称“顶点”),同时为8个晶胞所共用,因此每个“顶点”只有1/8属于该晶胞;
⑵凡处于立方体棱边上的微粒(简称“棱点”),同时为4个晶胞所共用,因此每个“棱点”只有1/4属于该晶胞;
⑷凡处于立方体内部的微粒(简称“体心”),完全属于该晶胞。
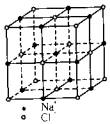
⒉ NaCl 晶体
由NaCl晶胞结构示意图可知,一个晶胞中:Na+的个数=1(体心)+12×(1/4)(棱点)=4(个),Cl-的个数=8×(1/8)(顶点)+6×(1/2)(面心)=4(个)
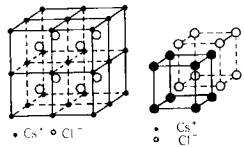
⒊ CsCl晶体
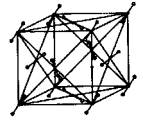
⒋ 干冰晶体
根据干冰晶体微小立方体结构示意图:
在每个CO2周围等距离且相距最近的CO2共有12个。
在每个小立方体中平均分摊到的CO2分子数=8×(1/8)(顶点)+6×(1/2)(面心)=4(个)
㈡ 笼状结构或无限网状结构问题
⒈ 金刚石
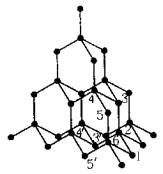
⒉ 石墨
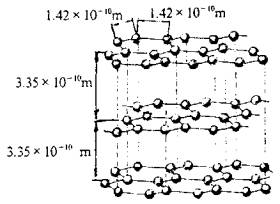
在石墨晶体中,碳原子构成的最小环为平面型六元环(与苯环相似),键角为120°,每个碳原子与相邻3个碳原子构成“实心”正三角形。其n(C):n(C-C)=1∶(3×1/2)=2∶3。每个碳原子被3个六元环共用,每条C—C键被2个六元环共用。
⒊ C60
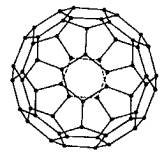
⑴ 欧拉定理:顶点数+面数棱边数=2
⑵ 考虑面对棱的分割:棱边数=五边形数×5/2+六边形数×6/2
⑶ 考虑点对棱的分割:棱边数=顶点数×3/2
⑷ 考虑面对点的分割:顶点数=五边形数×5/3+六边形数×6/3
⑸ 考虑总价电子数:顶点数×4=单键数×2+双键数×4
⑹ 考虑每个C只能形成两条C-C及一条C=C:单键数=双键数×2
⒋ SiO2晶体
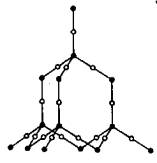
可以这样去理解SiO2的结构,即在晶体硅(结构同金刚石)中的Si—Si键间插入1个O原子。晶体中存在SiO4四面体及OSiO折线,∠OSiO=109°28′,∠SiOSi=104.5°(与HOH中键角相似)。晶体中最小环为十二元环,由6个Si和6个O构成。每个Si被2C24=12个十二元环共用,每个O被2C13=6个十二元环共用。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围的阳离子总配位数。我们称...
...
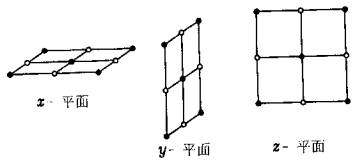
一、投影是什么? 从数学的角度来说,一般地,用光线照射物体,在某个平面上得到的影...
金刚石晶胞中的原子排列方式图进行计算。 ①空间占用率的计算: 图中的原子数目计算:...
微粒间距离的计算常常涉及晶体密度、 N A 、 M 、晶体体积等数据,解答这类题目时,一...
晶胞投影问题是 《 物质结构与性质 》 这一 部分的重点和难点 , 在高考中考查起点高...