
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
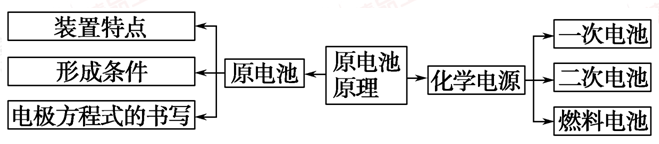
一、原电池:
盐桥的作用
(1)使整个装置构成闭合回路,代替两溶液直接接触。
(2)通过带电离子的定向移动,平衡烧杯中电解质溶液的电荷。通过盐桥中阴阳离子定向移动而使两极电解质溶液中正负电荷守恒而保持电中性。
(3)不能用一根导线连接,因为导线是不能传递阴阳离子的。
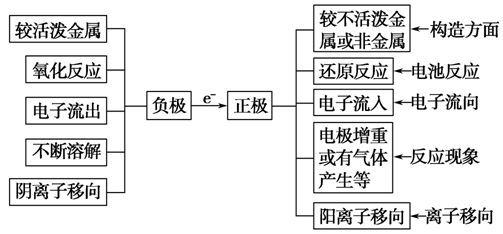
1、原电池电极的有关判定方法:
2、原电池原理在化工、农业生产及科研中的应用
①加快氧化还原反应的速率:一个自发进行的氧化还原反应,设计成原电池时反应速率增大。
②比较金属活动性强弱:两种金属分别做原电池的两极时,一般做负极的金属比做正极的金属活泼。
③用于金属的防护:使被保护的金属制品做原电池正极而得到保护。
④设计电池,制造化学电源。
⑤探究金属腐蚀的快慢规律,不同类型的腐蚀规律:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀
二、常见化学电源

电极反应式的书写:原电池反应的本质就是氧化还原反应。因此正确书写氧化还原反应方程式并能标出电子转移的方向和数目是正确书写电极反应式的基础,通过电池反应中转移电子的数目可确定电极反应中得失的电子数目,通过电池反应中的氧化剂、还原剂和氧化产物、还原产物可确定电极反应中的反应物和产物。具体步骤如下:
(1)首先根据题意写出电池反应。
(2)标出电子转移的方向和数目,指出氧化剂、还原剂。
(3)根据还原剂——负极材料,氧化产物——负极产物,氧化剂——正极材料,还原产物——正极产物来确定原电池的正、负极和反应产物。根据电池反应中转移电子的数目来确定电极反应中得失的电子数目。
(4)注意环境介质对反应产物的影响。
(5)写出正确的电极反应式。流程如下:

三、电解原理:
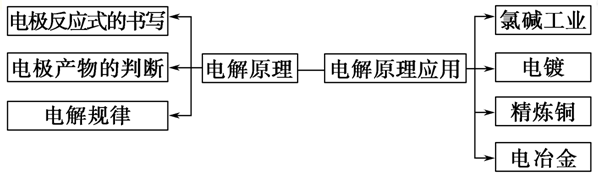
1、“三池”的判断技巧:
原电池、电解池、电镀池判定规律:若无外接电源,可能是原电池,然后依据原电池的形成条件分析判定,若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其他情况为电解池。
2、电解时电极产物的判断——“阳失阴得”,即

3、电解池中电极反应式的书写
(1)根据装置书写
①根据电源确定阴、阳两极→确定阳极是否是活性金属电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
②在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
(2)由氧化还原反应方程式书写电极反应式
①找出发生氧化反应和还原反应的物质→两极名称和反应物→利用得失电子守恒分别写出两极反应式。
②若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式即得另一电极反应式。
(3)电极反应式的书写——“二判二析一写”
二判:①判断阴阳极;②判断是电极材料放电还是溶液中的离子放电。
二析:①分析溶液中离子的种类;②根据离子放电顺序,分析电极反应。
一写:根据电极产物,写出电极反应式。
4、应对电化学定量计算的三种方法
(1)计算类型:原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数的计算、产物的量与电量关系的计算等。
(2)方法技巧:
①根据电子守恒计算:用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
③根据关系式计算:根据得失电子守恒定律关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。例如:
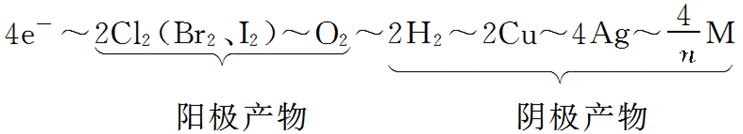
(式中M为金属,n为其离子的化合价数值)该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19C来计算电路中通过的电量。
5、电解池的“两看、五注意”审题法:
(1)两看:一看“电极材料”:若阳极材料是除金、铂以外的其他金属,则在电解过程中,优先考虑阳极材料本身失去电子被氧化,而不考虑溶液中阴离子放电的难易。再看“离子放电的难易”:若阳极材料是惰性电极,则在电解过程中首先分析溶液中离子放电的难易。
(2)五注意:
①注意正、负(阴、阳),抓守恒(电子、电荷),关注介质。当缺氧时,需加H2O生成H+或加OH-生成H2O或加CO32-生成CO2或加O2-生成H2O。
②在碱性介质中不能出现H+或CO2,酸性介质中不能出现OH-,特别要关注非水溶液介质(如熔融碳酸盐、熔融金属氧化物及氢化物)。
③Fe作电极失2e-生成Fe2+。
④二次电池放电时体现原电池原理,充电时体现电解池原理。
⑤电解池阳极阴离子的放电顺序(失电子由易到难)为S2->I->Br->Cl->OH->含氧酸根;阴极阳离子的放电顺序(得电子由易到难)为Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
6、分析电解过程的思维程序
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序。
7.规避电解池中方程式书写的3个易失分点
(1)书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。
(2)要确保两极电子转移数目相同,且注明条件“电解”。
(3)电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。
四、金属的腐蚀与防护
1、金属腐蚀的本质:
金属原子失去电子变为金属阳离子,金属发生氧化反应。
2、金属腐蚀的类型:
(1)化学腐蚀与电化学腐蚀:
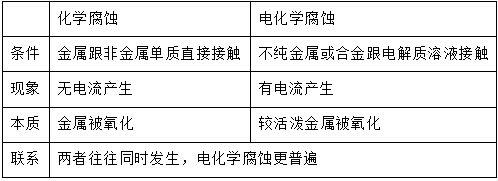
(2)析氢腐蚀与吸氧腐蚀:以钢铁的腐蚀为例进行分析:

(3)铁锈的形成:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3=Fe2O3·xH2O(铁锈)+(3-x)H2O。
3、金属的防护:
(1)电化学防护:
①牺牲阳极保护法—原电池原理
②外加电流的阴极保护法—电解原理
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
1、影响金属腐蚀的因素:
影响金属腐蚀的因素包括金属的本性和介质两个方面。就金属本性来说,金属越活泼,就越容易失去电子而被腐蚀。介质对金属的腐蚀的影响也很大,如果金属在潮湿的空气中,接触腐蚀性气体或电解质溶液,都容易被腐蚀。
2、金属腐蚀的快慢规律:
(1)不同类型的腐蚀规律:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。反之,防腐措施由好到差的顺序为:外接电源的阴极保护法防腐>牺牲阳极的阴极保护法防腐>有一般防护条件的防腐>无防护条件的防腐。
(2)电化学腐蚀规律:对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。
(3)活动性不同的两金属:活动性差别越大,活动性强的金属腐蚀越快。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快,且氧化剂的浓度越高,腐蚀越快。
(5)对于不同氧化剂来说,氧化性越强,金属腐蚀越快。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电化学原理是普通高中化学选择性必修1化学反应原理中的重要组成部分,也是高考化学中...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用下将化学能转化为电能的...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目新颖度高,学生因理不清交...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩散而引发的一类电池称...
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子电池等,把电解质存放在容...
11111...