
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、为什么通常用单位时间内浓度变化表示反应速率,而不用质量或物质的量表示?
一切知识皆是为生产、生活服务的,事实上,表示反应速率的快慢既可用物质的量,也可用质量,还可以用气体的体积等。而我们知道,化工生产反应总是在一定体积的反应器内发生的,我们不会在生产过程中突然停止一个化工反应过程去测定其速率,但可以随时取样进行检测。于是,通常采用单位时间内某种反应物浓度的减小或某种生成物浓度的增大表示反应速率,由于所取样品与反应器内的物料浓度是一致的,故用浓度变化表示反应速率,比较方便样品与反应器内物质变化量之间的换算。
至于规定反应速率总要为正值(反应物浓度的减小或产物浓度的增大),这只是一种历史习惯而已。
2、怎样用碰撞理论理解浓度、温度对反应速率的影响?
反应速率理论有很多,碰撞理论是其中一种,碰撞理论的基本假设是:反应物分子之间必须通过发生“有效碰撞”才能发生反应,而只有能量较高(运动速率较快)的分子之间才能发生有效碰撞,这样的分子叫“活化分子”。
依据反应速率的概念可知,反应速率越快意味着单位时间、单位体积内发生的有效碰撞次数越多。而这“单位时间、单位体积内的有效碰撞次数”则与单位体积内的活化分子数成正比。所以,从微观层面看,决定反应速率的根本因素,就是单位体积内活化分子数的多少。
a)浓度对单位体积内活化分子数的影响,如图1.
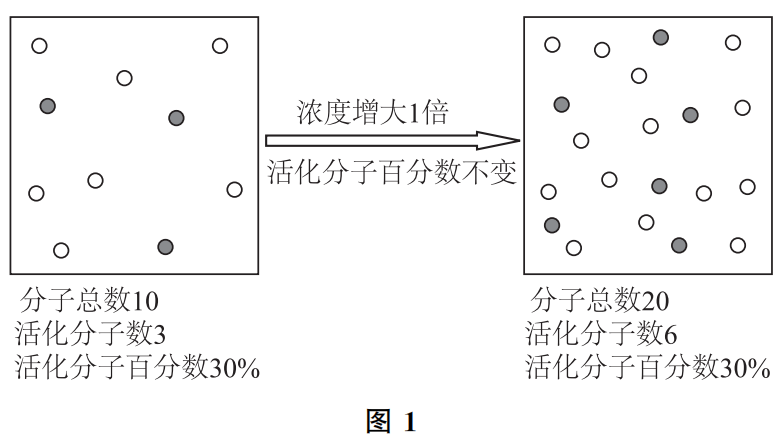
从图1可以看出,增大反应物的浓度,其实就是在不改变分子本身能量(不改变活化分子百分数)的情况下,通过增大分子总数,使单位体积内的活化分子数增加,进而使单位时间、单位体积内的有效碰撞次数增加,提高反应速率。
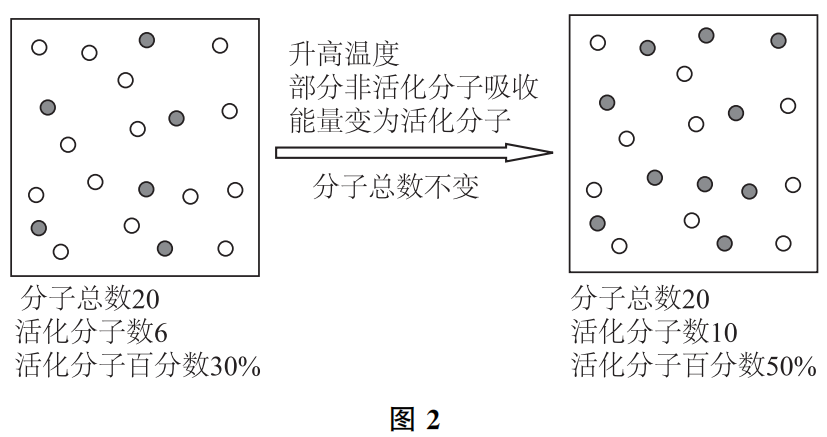
b)升高温度,是如何提高反应速率的呢?
温度的高低是微观粒子热运动剧烈程度的外在表现,升高温度,意味着给反应体系提供能量,使分子的平均能量增加,运动速率加快。这样一来,原来一部分能量较高的非活化分子吸收能量后变为活化分子,提高了活化分子百分数。于是,在反应物分子总数不变的情况下,通过提高活化分子百分数,增大了单位体积内的活化分子数,请参考图2。当然,升高温度,分子的平均动能增大,导致单位时间内碰撞的总次数增加,这也是温度影响反应速率的一个微观因素。
3、为什么说压强的改变归根到底是引起反应物浓度的变化?
对于有气体参与的反应来说,其他条件不变的情况下,增大反应体系的压强会导致气体体积的减小,各种反应物的浓度随之增大。故增大反应体系的压强,可以使反应速率加快.请参考图3.
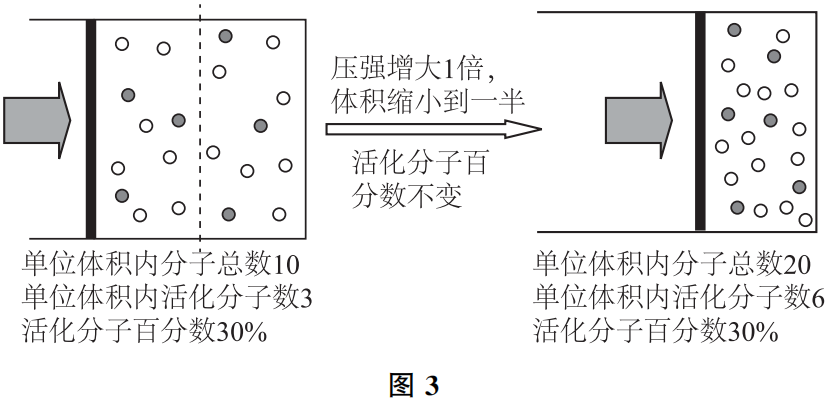
由于压强对液体与固体的体积影响极小,故对没有气体参与的反应,压强对反应速率的影响可忽略不计。
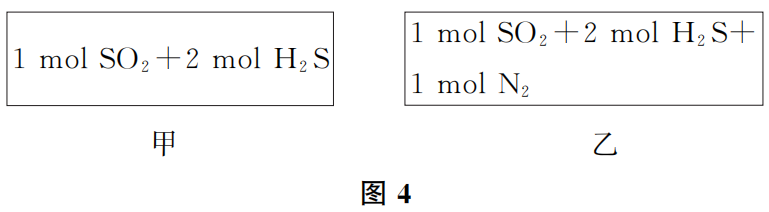
如果改变压强并没有引起反应器体积的改变,各反应物浓度没有因此发生变化,那么就不会导致反应速率的变化。图4所示的2个容器恒容且容积相同,在温度相同的情况下,虽然右侧容器内因加入惰性气体N2使压强增大,但反应速率不会比左侧容器大,因为反应物SO2和H2S的浓度没有因N2的加入而发生任何变化。
4、升高温度和使用催化剂均能提高活化分子的百分数,这2条途径有什么不同吗?
前文已经分析了升高温度提高活化分子百分数的实质—使反应物分子的平均动能增大,分子本身的能量因温度升高而提高。
催化剂是先参与了反应过程,反应的后期又生成出来的物质.它使得反应路径发生了改变,降低了反应的活化能(指正催化剂)。以SO2催化氧化反应为例粗略说明如下:
总反应:2SO2+O2=2SO3.
该反应要求SO2、O2分子间直接碰撞,需要它们均具有较高的能量(即分子以较快的速率发生碰撞)。
现使用V2O5为催化剂后,反应路径变为:
2SO2+2V2O5=2SO3+2V2O4,
2V2O4+O2=2V2O5,
即SO2、O2分别与V2O5和V2O4发生碰撞,这2个反应对于SO2、O2的能量要求均降低了,故原来直接反应路径下的很多非活化分子,在该反应条件下则是活化分子,活化分子的百分数提高了,但反应物分子本身的能量并没有发生任何改变。请参考图5.
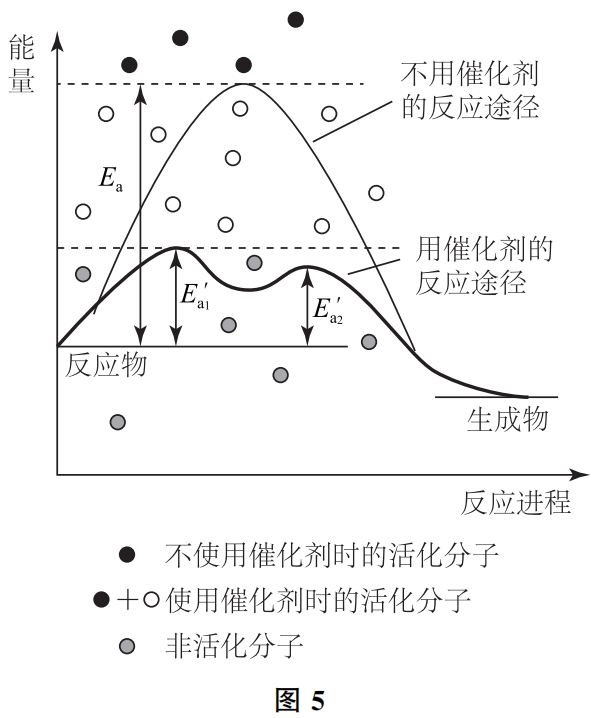
我们还可以做如下形象化的比喻:男女老幼一群人攀越一座高山(参加反应)。可想而知,只有少数体力很好的青壮年人才能翻越,这些人就相当于未使用催化剂时的活化分子;若在山腰开凿一条隧道,则能够翻越的人数大大增加,相当于使用催化剂后改变了反应路径,活化分子的百分数增大了;那些连隧道也不能独立穿越的人则相当于使用催化剂条件下的非活化分子。
5、反应速率与反应物浓度是否存在定量关系?
科学家经过长期的研究发现,对于一步即可实现的反应(这种反应称为“基元反应”)来说,反应物浓度与反应速率之间确实存在定量关系。
对于基元反应:aA+bB=gG+hH,有如下关系:
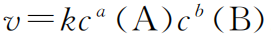
上式称为“反应速率方程”,其中K叫“速率常数”,K不随浓度变化,但与温度有关;a和b之和称为这个基元反应的“反应级数”,表示需要有a个A的分子和b个B的分子同时发生碰撞才能发生该反应。
可以设想,二级反应(双分子碰撞)较多,三级及以上的基元反应极少,因为3个或更多个指定种类的分子同时按规定的取向发生碰撞的概率毕竟太小了。
值得注意的是,一个反应是否为基元反应,不是通过观察化学方程式就能够断定的,需要通过实验具体测定。对该问题感兴趣的同学,可以在课外进行深入学习。
经典的反应速率理论有碰撞理论、过渡态理论(活化络合物理论)等,它们的呈现方式略有差异,在本质上其实是一样的。
6、活化分子之间发生的碰撞,为什么不一定是有效碰撞?
只有活化分子间才能发生有效碰撞,但活化分子间发生的每一次碰撞并非都一定是有效碰撞。
这是因为,分子都有其独特的空间构型,发生碰撞的方向很重要.举一个简单的例子:
反应NO2+CO=NO+CO2中,NO2与CO分子碰撞的取向有多种,下图示意了2种比较典型的方向:
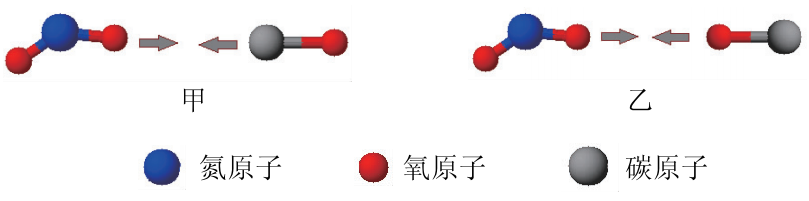
NO2氧化CO的反应本质上就是氧原子由NO2分子向CO分子传递的过程,显然甲种碰撞有利于氧原子的传递,乙种以及许多其他碰撞方式都是难以引发氧原子传递的,属于无效碰撞。
虽然活化分子之间发生的不一定是有效碰撞,但在单位体积内活化分子数一定的情况下,取向合理的有效碰撞次数和取向不合理的无效碰撞次数比例是一定的,故反应速率还是与单位体积内的活化分子数直接关联的.
7、一个能量极高的活化分子与一个非活化分子之间,能不能发生有效碰撞呢?
活化分子是一个微观层面的概念,实际上因为每一个分子都在不停地运动着,不停地与别的分子发生碰撞并交换能量,可谓瞬息万变。一个原本速率很大的分子,在与别的分子碰撞交换能量后的下一个瞬间则可能变为普通分子。
有效碰撞是描述反应速率的微观概念,应该只具有统计学意义,也就是说,如果真有一个能量很高的活化分子与另一个能量略低于活化分子的分子按照合理的取向发生了碰撞,若二者的平均能量达到活化分子的能量水平,发生的则是有效碰撞.这种情况下,2个分子其实都被统计为活化分子.换句话说,其实并不存在一个个具体的、可观察的活化分子与非活化分子.
8、正催化剂是改变反应途径,降低活化能,从而提高反应速率的.那么负催化剂的作用机理是什么呢?如果也是改变了反应途径,从而提高了活化能,那么,为什么反应物分子不“绕开催化剂”直接发生碰撞呢?这样的话,负催化剂不就起不了作用吗?
这是一个非常有趣的问题.首先要明确,催化剂虽然很神奇,但它不是“神药”,千万不要以为任何时候,只用一点点催化剂即可持久循环加速反应了.从催化机理看,催化剂其实也是反应物之一,其浓度(对于表面催化反应来说,则指催化剂的表面积)大小会直接影响反应的速率.
让我们先通过一个实例说明负催化剂是如何参与反应过程的。
一定量的盐酸与镁条反应制取H2,实验过程中,发现反应速率过快,我们希望适度减缓反应速率,以便于收集气体.这时,可采取加入一定量CH3COONa的办法.加入CH3COONa后,CH3COO-即与H+迅速结合形成弱电解质CH3COOH,导致溶液中游离的H+浓度大幅度降低,Mg与H+的置换反应速率得以减缓.随着Mg+2H+=Mg2++H2↑反应的不断进行,体系内游离的H+浓度下降,则CH3COOH会持续不断地发生电离,缓慢释放出H+.最终,全部CH3COOH电离完毕,H+全部被Mg还原为H2,CH3COO-则恢复到初始加入的量.显然,CH3COO-就是该反应的负催化剂,从宏观上看,它的加入减缓(改变)了Mg与酸的反应速率,而自身的化学性质、物质的量保持不变,从微观过程看,它先是参与了反应,最终又生成出来.
由于反应的动力学原因,Mg与H+的作用是不可能避开CH3COO-的,因为CH3COO-与H+的结合反应迅速而完全.如果Mg和H+可以避开CH3COO-而直接发生作用,那只能说明CH3COO-加入的量不够,尚不能充分发挥预期的负催化剂作用。
正催化剂的作用机理也是一样,必须加入足够的量(浓度),才能达到我们预期的催化效果,将反应速率提高到期望值。
9、如何理解任何反应都具有一定程度的可逆性?
任何化学反应都有一定的可逆性,只是一定温度下其平衡常数大小不同而已,让我们结合下图对此规律加以理解:
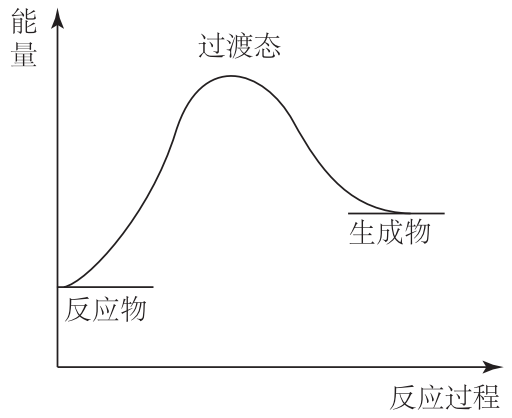
如图所示,任何化学反应,在反应物、生成物之间都要经历一个高能量的过渡态(中间态),此过渡态的能量比反应物、生成物都要高,它既有向前转化变为生成物的可能,也有向相反方向转化变为反应物的可能。同理,此过渡态既可由反应物出发生成,也可由生成物出发生成。
若是“反应物→过渡态→产物”,称之为正反应;若是“产物→过渡态→反应物”,称之为逆反应。
现在假设我们能够让反应从过渡态开始,最终会得到什么呢,反应物还是生成物?参考上述图象可知,其实二者都可以得到。从图中可直观地看出,一定量的过渡态物质,转变为反应物后,体系的总能量可以更低,因此最终所得反应物要比产物的比例大些。
这是符合化学平衡原理的结果,如果图象中纵坐标的能量代表体系的自由能(G),则最终所得反应物、产物的比例,决定于反应物、产物自由能之差(ΔG)。对于此反应来说,ΔG越大,则平衡体系内产物的比例越小.对于ΔG极大的反应来说,由于产物的比例极小,以至于可以忽略不计,我们说该反应不会发生。相反,如果一个反应的ΔG是负值且非常非常负,则该反应最终达到平衡状态时,反应物所占比例小到忽略不计,则我们说该反应不具有可逆性.
物理化学相关书籍里有关于ΔG与反应平衡常数的具体关系式,对此感兴趣的同学可以在课外进行深入学习。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是能垒、活化能?二者有什么区别? 1、能垒 活化分子含有的能参加化学反应的最低...
1.无论是用某一反应物表示还是用某一生成物表示,由于Δ C 是取浓度变化的绝对值,因...
在一个恒温恒容的密闭容器里,充入2mol SO 2 和1mol O 2 ,发生如下反应并建立化学平...
...
一、人物简介: 阿伦尼乌斯·斯万特·奥古斯特(1859年2月19日~1927年10月2日)瑞典物...
本题考查了阿伦尼乌斯公式中温度和速率常数的关系,即温度升高,速率常数变大。 本题...