
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对于同一还原剂来说,硝酸越稀,被还原产物中氮的氧化数降低得越多,但绝不能认为氧化数改变越多则氧化性愈强,从而造成浓硝酸氧化性不及稀硝酸的错觉。实际上硝酸浓度越高,氧化性愈强。这可从以下几方面进行说明。
(1) 从HNO3与NO3-结构的稳定性来看
硝酸分子是平面型结构,其中氮原子是sp2杂化的,它的3个 sp2杂化轨道与3个氧原子之间形成3个σ键,另外1个垂直于 sp2平面的p轨道中的1对电子和2个氧原子,p轨道中的单电子 形成1个三原子四电子的离域π键 ,在下图中用虚线表示。
,在下图中用虚线表示。
NO3-为平面结构,每个O—N —O键角为120°, N原子采用 sp2杂化轨道与3个O原子形成3个σ键。N原子π轨道中的1 对π电子和3个O原子各提供1个成单电子,再加上外来的1个 电子形成六电子四中心的不定域大π键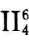 。因此NO3-比HNO3 稳定得多。在浓硝酸中,〔H+〕、〔HNO3〕均比稀硝酸大,所以浓 硝酸氧化性比稀硝酸强。
。因此NO3-比HNO3 稳定得多。在浓硝酸中,〔H+〕、〔HNO3〕均比稀硝酸大,所以浓 硝酸氧化性比稀硝酸强。
(2) 从电极电位来看
从下面两个反应可以看出在酸性溶液中值明显增大。
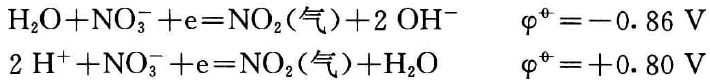
由此可以说明硝酸浓度越大,〔H+〕越大,氧化性越强。
(3) 从有关化学平衡来看
3NO2+H2O  2 HNO3+NO ΔH=- 138 KJ/ mol-1
2 HNO3+NO ΔH=- 138 KJ/ mol-1
浓硝酸跟金属反应时,最初也可能生成NO,但由于硝酸浓度 大,氧化性强,把NO氧化成了 NO2,使平衡强烈地向左移动,主 要产物是NO2。当稀硝酸与余属反应时,由于硝酸浓度小,氧化 性较弱,不能进一步氧化生成NO,主要还原产物是NO。
浓硝酸氧化性远大于稀硝酸,还可以从下述实验得以证明:
(1) 稀硝酸与硫化物反应时,只能将S2-离子氧化成单质硫; 而浓硝酸与硫化物反应时,能将S2-离子进一步氧化成SO42- 离子。
3 PbS + 8 HNO3(稀)=3 Pb(NO3)2 + 2 NO +3 S + 4H2O
PbS+8 HNO3(浓)=PbSO4 + 8 NO2 +4 H2O
(2) 稀硝酸只能把砷氧化成亚砷酸,而浓硝酸则能进一步把亚 砷酸氧化成砷酸。
As+HNO3(稀)+H2O=H3AsO3+NO
H3AsO3+2 HNO3 (浓)= H3AsO4 + 2 NO2 +H2O
(3) 稀硝酸只能将氢碘酸氧化成单质碘,浓硝酸则能把氢碘酸氧化成碘酸。
6 HI+2 HNO3(稀)=3 I2+2 NO +4 H2O
HI+6 HNO3(浓)=HIO3 + 6 NO2 +3 H2O

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。硝化作用:氨氮到硝酸盐的神奇变身 硝化作用是土壤微生物参与的将氨氮(NH 3 /NH 4 + ...
磷有多种含氧酸,较重要的有以下几种: 名 称 正磷酸 焦磷酸 亚磷酸 次磷酸 三磷酸 偏...
硒相关知识在信息题量经常会涉及,为此,能对硒有一些了解也会大有益处的。 1、保健元...
石膏的利用与开发 人类对石膏的利用,至少也有上千年了。古代的中医就用石膏作为清热...
铵盐都是离子化合物。 离子化合物溶于水经历两个基本过程,一是吸收能量离子键的断裂...
氮气与氩气都是惰性气体!只是氮气没氩气惰,看看他们的性质吧: 一、氮气: 1.物理性...