
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、中心原子杂化类型对键角大小有决定性的影响
中心原子杂化类式是决定键角大小的最根本的原因。
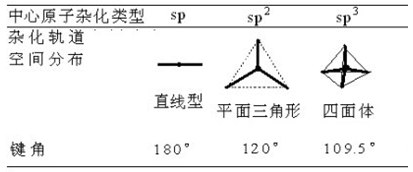
上表由前(左)到后(右)的顺序就基本是一个键角逐渐减小的顺序。
例1,对CH4、BF3、CO2这一分子序列,中心原子分别为sp3、sp2和sp杂化,它们对应的键角为109°28′、120°、180°,键角会依次增大。
二、中心原子孤电子对数目对键角的影响
由于中心原子的孤对电子的电子云肥大,对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小。且中心原子的孤电子对数越多,键角会变得越小。
例2,对H2O、NH3、CH4分子系列。这3个分子的中心原子采取的都是sp3杂化,但孤电子对数不同。其孤电子对数分别为2、1、0.。在H2O分子中,键角要受2个孤电子对的压缩,键角应该会最小。这就导致出推断:该序列是一个键角逐渐增大的序列。可查得它们的键角分别是104.5°、107.1°、109.5°。
三、中心原子电负性对键角的影响
当同主族中心原子种类不同,但杂化类型相同、且配原子种类相同时,中心原子的电负性大,成键电子对更靠近中心原子,成键电子对间的斥力要变大,键角要变大。反之,中心原子电负性小的分子,成键电子对要远离中心原子,成键电子对间的斥力要变小,键角要变小。
例3,比较典型的例子是H2O与H2S的键角。通常认为其中的O与S原子都采取了sp3杂化,都有2个孤电子对。但O原子的电负性大,键角应该H2O比H2S中的键角大。又例如:PH3的键角是96.3°,NH3键角是107°
四、配原子电负性对键角的影响
例4,将NF3与NH3比较,中心原子都是N原子、且都为sp3杂化,但因为F原子的电负性大于H原子,使成键电子离N原子更远,两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。实际上:NH3的键角是107°,NF3的键角是102.5°.
对常遇到的H2O与OF2分子的键角和极性比较,也可照上例来判断。
一看中心原子杂化类型,(见例1)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...
1.非环状小分子和离子中的大π键:大多数满足AB n 型,可以计算杂化类型。 首先:参与...
1.σ键与π键 σ键:原子轨道沿着轨道对称轴的方向“头碰头”重叠形成的共价键。 π键...