
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
盐的溶解性是元素及化合物所研究的重点领域之一,了解该特性有助于正确合成路线的选择化合物的分离、提纯及检测,揭示其中的规律不仅是科学研究的需要,更是理论指导实践的必然选择,
1、离子性盐类溶解性慨况
离子性盐类主要包括碱金属和碱土金属的卤化物、硝酸盐、硫酸盐、碳酸盐和磷酸盐, 该类盐具有如下特征: 对于碱金属盐类而言绝大多数是易溶于水的,只有少数离子半径较小的锂盐如LiF、Li2CO3和 L I3PO4等及由大阴离子和较大阳离子组成的钠盐和钾盐如六羟基锑酸钠、醋酸铀、酰锌钠、酒石酸氢钾、高氯酸钾、六氯合铂酸钾、四苯硼酸钾等是难溶于水的, 碱土金属与碱金属相比由于其离子电荷增加,半径减小导致其离子势和极化能力较碱金属要强而表现出与碱金属不同的特性: 碱土金属相比碱金属盐而言其溶解度一般较小,而且不少碱土金属盐是难溶的,这是碱金属和碱土金属的重要差别之一, 对于碱土金属盐来说易溶的有硝酸盐、氯酸盐、高氯酸盐、乙酸盐、和卤化物( 除氟化物外) ,难溶的盐有碳酸盐、草酸盐和磷酸盐,对于不同碱土金属的硫酸盐和铬酸盐,其溶解度差别较大,如铍的硫酸和铬酸盐是易溶的而钡盐则是难溶的,
2、离子性盐溶解性解析
物质在溶剂中的溶解是一个极为复杂的过程,在该过程中究竟有哪些内在因素决定物质的溶解性能? 我们可以从三个层面即热化学、溶解过程的能量变化和微观结构来加以解析这类盐溶解性规律背后所蕴藏的本质要素,
2.1 热力学要素对物质溶解性的影响
在一定的条件下一个化学反应能否自动进行,进行的方向和进行的程度如何,这是化学热力学所要研究的范畴, 物质溶解过程到底能否自发进行,可以通过计算出该过程在标准状态下吉布斯自由能![]() 的变化值,如果该过程的
的变化值,如果该过程的![]() 值为负,在热力学层面上我们就可以判断该溶解过程是可以自发进行的即易于溶解,否则就是难溶的,一些碱金属和碱土金属在水中的
值为负,在热力学层面上我们就可以判断该溶解过程是可以自发进行的即易于溶解,否则就是难溶的,一些碱金属和碱土金属在水中的![]() 值通过物理化学手册很容易查出,这为我们通过热力学方法来解释物质的溶解性提供了很大的方便, 例如,判断CaCl2和CaF2常温条件下在水中的溶解性,我们可以计算该状态下的
值通过物理化学手册很容易查出,这为我们通过热力学方法来解释物质的溶解性提供了很大的方便, 例如,判断CaCl2和CaF2常温条件下在水中的溶解性,我们可以计算该状态下的![]() 值,通过计算得出298K时,CaCl2的
值,通过计算得出298K时,CaCl2的![]() 为-86KJ/mol,该值小于零,热力学判断该溶解过程是可以自发进行的,而CaF2的
为-86KJ/mol,该值小于零,热力学判断该溶解过程是可以自发进行的,而CaF2的![]() 为56KJ/mol ,值大于零,热力学判断该溶解过程是不能自发进行的,该判断与CaCl2易溶和 CaF2难溶的实验结果相一致, 然而,用
为56KJ/mol ,值大于零,热力学判断该溶解过程是不能自发进行的,该判断与CaCl2易溶和 CaF2难溶的实验结果相一致, 然而,用 ![]() 值是大于零还是小于零作为难溶或是易溶的分界线,有时往往会出现理论判断与实际不符的情况,如K2SO4和Na2SO4都是易溶盐,但其溶解过程的
值是大于零还是小于零作为难溶或是易溶的分界线,有时往往会出现理论判断与实际不符的情况,如K2SO4和Na2SO4都是易溶盐,但其溶解过程的![]() 都大于零( 分别为10KJ/mol和1KJ/mol,说明用
都大于零( 分别为10KJ/mol和1KJ/mol,说明用![]() 值是大于零还是小于零作为难溶或是易溶的判断还过于粗糙,必须引入更为精确的处理方法, 目前通常假定溶解度0.01mol/L 为判断易溶和难溶的分界线,溶解度大于0.01mol/L 者为易溶盐,而溶解度小于0.01mol/L 者为难溶盐, 精确处理过程如下: 先计算溶解度为0.01mol/L 盐溶解过程的溶度积常数,再求出
值是大于零还是小于零作为难溶或是易溶的判断还过于粗糙,必须引入更为精确的处理方法, 目前通常假定溶解度0.01mol/L 为判断易溶和难溶的分界线,溶解度大于0.01mol/L 者为易溶盐,而溶解度小于0.01mol/L 者为难溶盐, 精确处理过程如下: 先计算溶解度为0.01mol/L 盐溶解过程的溶度积常数,再求出![]() ,以溶解度盐溶解过程的
,以溶解度盐溶解过程的![]() 值作为判断难溶或易溶的分界线就可以得到与实验较吻合的结论, 下面就以1-1 或1-2 型盐为例,看看精确处理判断过程:
值作为判断难溶或易溶的分界线就可以得到与实验较吻合的结论, 下面就以1-1 或1-2 型盐为例,看看精确处理判断过程:
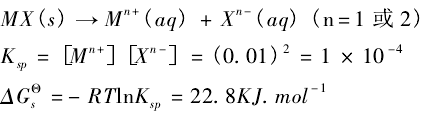
将某个1-1或 1-2型盐的![]() 值与22.8KJ/mol进行比较: 大于属难溶盐,小于则属易溶盐, 对于其他类型盐的界线值可用同样的方法计算得出:1-2 型为或2-1 型为30.8KJ/mol;1-3型或3-1 型为38.5KJ/mol;3-2 型为或2-3 型为45.6KJ/mol;
值与22.8KJ/mol进行比较: 大于属难溶盐,小于则属易溶盐, 对于其他类型盐的界线值可用同样的方法计算得出:1-2 型为或2-1 型为30.8KJ/mol;1-3型或3-1 型为38.5KJ/mol;3-2 型为或2-3 型为45.6KJ/mol;
2.2 能量和熵因素对离子型盐溶解性能的影响
上部分我们用了热力学知识中的一个重要函数’盐溶解过程的吉布斯自由能![]() 改变量来解析了离子性盐在水中溶解性,那么具体影响这一函数值大小的决定要素又有哪些呢? 一般来说,影响
改变量来解析了离子性盐在水中溶解性,那么具体影响这一函数值大小的决定要素又有哪些呢? 一般来说,影响![]() 的主要因素包括晶格能、水合能和熵。
的主要因素包括晶格能、水合能和熵。
溶解过程就是盐由晶体状态在水中变成水合离子的过程,该过程所涉及的能量变化包括两个方面 一是由离子晶体升华为分离的气态自由离子所需要消耗的能量,该项所需要的能量越高,表示该晶体中的离子键越强,晶体越稳定,这一过程所涉及的是一个吸热过程, 从能量角度来说,所需能量越高,该过程越不易进行,也就是说该项对盐溶解的影响是负面的, 另一个能量影响要素是气态自由离子与水形成水合离子的过程,该过程所涉及的是一个放热过程, 从能量角度来说,放出的能量越高,该过程就越易进行,也就是说该项对盐溶解的影响是正面的, 溶解中所涉及的两步能量过程对盐的溶解性影响是绝然相反的,那么哪一种途径占主导优势就会决定离子性盐在水中究竟是难溶或是易溶,如果溶解过程中晶体升华成自由气体离子所需要消耗的能量要高于自由离子水合过程中所放出的能量,那么就可以粗略的判断该盐难于溶解或溶解度较小,反之则易溶或溶解度较大,
2.2.1熵对离子性盐溶解性的影响
根据公式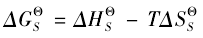 可以看出在一定的温度下,影响
可以看出在一定的温度下,影响![]() 的因素有两项 :
的因素有两项 :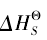 和
和 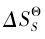 , 当
, 当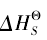 占主导优势时,可以不考虑熵的影响,当熵的影响占主导时就不能被忽视, 如 KNO3单从焓变看其为正值不利于溶解,事实上它是易溶于水的,这主要是该溶解过程的熵变增大,有利于该盐的溶解, 因此,在判断盐溶解时应综合该过程的焓效应和熵效应才能得出较为满意的结果,
占主导优势时,可以不考虑熵的影响,当熵的影响占主导时就不能被忽视, 如 KNO3单从焓变看其为正值不利于溶解,事实上它是易溶于水的,这主要是该溶解过程的熵变增大,有利于该盐的溶解, 因此,在判断盐溶解时应综合该过程的焓效应和熵效应才能得出较为满意的结果,
2.3阴阳离子结构对溶解性的影响
2.3.1巴索洛经验规则
当阴阳离子电荷的绝对值相同而它们的离子半径相近时所生成的盐类一般都难溶于水,而阴阳离子半径相差较大时,所形成的盐类一般易溶于水, 也就是说小阳离子与小阴离子、大阳离子和大阴离子相结合形成的盐结构一般是稳定的而难溶于水,而小阳离子与大阴离子或大阳离子与小阴离子结合所形成的盐一般是不稳定的而易溶于水, 如LiF 和 CsF,前者为小阳离子配小阴离子,后者为大阳离子配大阴离子能形成结构稳定的盐而难溶于水, 而LiI 和CsF 所形成的盐阴阳离子半径相配失恒形成结构不稳定的盐而易溶于水, 在数据不完备的情况下我们可以通过盐中阴阳离子的匹配关系来粗略判断盐的溶解性,
2.3.2软硬酸碱(HSAB)规则
按照酸碱电子理论,物质形成过程中始终存在电子的接收和给予,从广义的角度来看是一个酸碱反应,Pearson 在前人广义酸碱理论基础上,进一步将其分为硬、软和交界酸碱。 硬和软只是形象的表示它们的极化变形能力, 硬酸是指受电子原子体积小,电荷高,不易极化变形,也不易失去电子; 相反,软酸是指受电子原子体积大,电荷低,具有很高的极化率且易失去电子; 硬碱是指那些给电子原子电负性大,变形性小且难失去电子如F-、OH-等, 软碱则是指给电子原子电负性小,变形性大且易失去电子, 1963年Pearson 在总结大量实验材料的基础上提出一个经验规则:硬亲硬,软亲软,软硬交界就不管,称之为软硬酸碱 规则, 它的意思是说硬酸与硬碱,软酸与软碱可以形成最稳定的化合物,而硬酸和软碱或软酸与硬碱所形成的化合物是不稳定的, 物质的稳定性与其在水中的溶解性是一脉相承的,了解物质的稳定性就可以大致推断出其在水中的溶解特性, 如 LiF,Li-半径小是硬酸,F-半径小为硬碱,硬酸与硬碱结合形成的化合物LiF很稳定因而难溶于水,
影响盐溶解的因素是多种多样的,了解这些因素将更加有利于增强我们解决实际工作中所遇到的问题的针对性。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。离子极化与影响元素 离子极化理论是离子键理论的重要补充。 离子极化理论认为:离子化...
原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来自双方原子,这样...
p区元素化学的学习中我们常常发现,很多非金属含氧酸的游离酸不能稳定存在,但是它们...
不是的。 只能提供一对孤对电子与中心原子形成配位键,被称为单齿配体,如H 2 O分子、...
磷的含氧酸共有四种: 磷酸(H 3 PO 4 ),结构式 :三元中强酸,非氧化性的酸,难挥...
对于典型的离子晶体来说,位于晶格结点位置的微粒是正负离子,但是稳定的离子晶体一定...