
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在日常教学中发现学生对于熵判据的理解比较困难,在课后的作业完成中也有部分学生对熵判据考查的题目无从下手。首先我们需要明确单独使用熵判据对化学反应方向进行独立判断是片面的,有了这个前提,我们在这个知识点的要求上,只需要了解基本的熵变判断和熵变决定化学反应方向的几种情况就可以了。
(1)熵的定义:
用来度量体系混乱程度的物理量。符号:S。单位:J·mol-1·K-1。
(2)常规熵值大小的判断:
同一物质的不同状态中熵值关系为气体﹥液体﹥固体
例如:少量食盐溶于水中(固体→液体) ΔS﹥0
(3)熵变决定化学反应方向的一般情况(具有片面性)
①许多熵增大的反应在常温、常压下可以自发进行。产生气体的反应,气体的物质的量增大的反应,熵变为正值,为熵增反应。
例如:H2O2(aq) 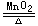 2H2O(l) + O2(g)
2H2O(l) + O2(g)
②有些熵增加的反应在常温、常压下不能自发进行,但在温度较高的情况下可以自发进行。
例如:CaCO3(s)  CaO(s) + CO2(g)
CaO(s) + CO2(g)
③少数熵减反应,在一定条件下也可以自发进行。
例如:2H2(g) + O2(g)  2H2O(l)
2H2O(l)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一.核心概念辨析 中间体:寿命长于分子振动的瞬态物种,多步...
活化分子百分数和活化分子数,理解它对掌握化学反应速率至关...
化学反应的焓变越大,代表这个反应受温度变化的影响越大吗?...
在化学热力学和分析化学中,我们常常听到这样的说法:“如果...
...
一、 什么是活化能? 活化能,通常用符号Ea表示,其标准单位为...