
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氢氧化铝是一种两性氢氧化物。它在水溶液中存在两种形式的电离。其电离方程式可表示如下:
![]()
应用氢氧化铝的上述电离方程式,不但可以解释氢氧化铝具有两性的原因,而且还可以熟悉氢氧化铝的制法、了解“双水解”的概念和判断溶液中某些离子能否共存的问题等。
(1)由Al3+转化为Al(OH)3
分析:Al(OH)3的碱式电离可知,要使Al3+向生成Al(OH)3转化,要提供适量的OH-,平衡才能向左移动产生Al(OH)3;但过量的OH-会使H+减少,而促使Al(OH)3发生酸式电离。1mol Al3+需和3mol OH-反应,产生的Al(OH)3沉淀为最大量。对1mol Al3+提供的OH-若超过3mol,Al(OH)3的量会越来越少。当OH-达到4mol 时,溶液中的Al(OH)3就完全溶解,没有任何沉淀。
例1为使Al3+转化为Al(OH)3沉淀,正确的方法有____。
A.加入强碱溶液 B.加入大量的水 C.加入氨水 D.加入强碱弱酸盐溶液
分析:(A)选项对强碱溶液的用量未加明确的限制,所以此法不正确。(B)Al3+能发生水解:Al3++3H2O![]() Al(OH)3(胶体)+3H+。但所产生的Al(OH)3因量少一般不产生沉淀。(C)弱碱本身在溶液中存在电离平衡。例如,NH3·H2O
Al(OH)3(胶体)+3H+。但所产生的Al(OH)3因量少一般不产生沉淀。(C)弱碱本身在溶液中存在电离平衡。例如,NH3·H2O![]() NH4++OH-,因而所能提供的OH-不会过量。向AlCl3溶液中滴加氨水产生Al(OH)3的同时,也产生了铵盐NH4Cl,NH4+对氨水的电离有抑制作用,所以产物Al(OH)3就难溶于过量的氨水中。(D)强碱弱酸盐在水溶液中发生水解而使溶液显碱性。水解只能提供适量的OH-。例如在Al2(SO4)3溶液中分别加入NaHCO3、Na2CO3、NaAlO2等强碱弱酸盐溶液,由于Al3+水解后使溶液中有较多的H+,而这些加入的溶液由于水解会使溶液中有较多的OH-,H+与OH-中和,就发生所谓“双水解”反应,生成的Al(OH)3由于OH-仅为适量也不会溶解。根据这一原理,人们就制成泡沫灭火器:
NH4++OH-,因而所能提供的OH-不会过量。向AlCl3溶液中滴加氨水产生Al(OH)3的同时,也产生了铵盐NH4Cl,NH4+对氨水的电离有抑制作用,所以产物Al(OH)3就难溶于过量的氨水中。(D)强碱弱酸盐在水溶液中发生水解而使溶液显碱性。水解只能提供适量的OH-。例如在Al2(SO4)3溶液中分别加入NaHCO3、Na2CO3、NaAlO2等强碱弱酸盐溶液,由于Al3+水解后使溶液中有较多的H+,而这些加入的溶液由于水解会使溶液中有较多的OH-,H+与OH-中和,就发生所谓“双水解”反应,生成的Al(OH)3由于OH-仅为适量也不会溶解。根据这一原理,人们就制成泡沫灭火器:
Al2(SO4)3+6NaHCO3![]() 2Al(OH)3↓+3Na2SO4+6CO2↑
2Al(OH)3↓+3Na2SO4+6CO2↑
答案:C D
例2下列四组离子在水溶液中能共存的是____。
A.Al3+和H+ B.Al3+和OH- C.Al3+和AlO2- D.Al3+和CO32-
解:在溶液中,Al3+不能跟OH-共存,也不能跟水解后产生OH-的阴离子,如CO32-、AlO2-、HCO3-等共存。本题选(A)
2.由AlO2-转化为Al(OH)3
分析:Al(OH)3的酸式电离可知,要使AlO2-转化为Al(OH)3,一定要提供适量的H+。过量的H+会使Al(OH)3发生碱式电离而减少。对1mol AlO2-只要提供1mol H+,在水溶液中即能产生1mol Al(OH)3沉淀。当加入4mol H+后,溶液中就不再存在Al(OH)3的沉淀。
为使AlO2-转变成Al(OH)3沉淀,提供适量H+的方法是①加入适量的强酸,②加入弱酸溶液,③加入强酸弱碱盐溶液。例如:
NaAlO2+H2O+HCl![]() NaCl+Al(OH)3↓
NaCl+Al(OH)3↓
2NaAlO2+3H2O+CO2![]() 2Al(OH)3↓+Na2CO3
2Al(OH)3↓+Na2CO3
3NaAlO2+AlCl3+6H2O![]() 4Al(OH)3↓+3NaCl
4Al(OH)3↓+3NaCl
例3在10mL 至少含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:
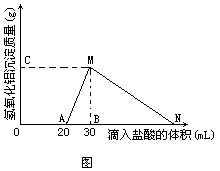
(1)此溶液中同时含有____mol____离子;
(2)线段AM表示的意义是____,MN表示的意义是____;
(3)点M表示的意义是____,点N表示的意义是____;
(4)M点的纵坐标为0.78,则[AlO2-]=____;
(5)点B的横坐标为30,则到点N处滴入的NaOH溶液体积为____mL。
分析由图象分析,和AlO2-共存的离子有OH-离子,滴入盐酸时,这部分OH-首先发生反应。待它们全部转变成H2O后,即开始出现Al(OH)3沉淀:
AlO2-+H2O+H+![]() Al(OH)3↓
Al(OH)3↓
待产生最大量(点M或C的纵坐标所示)后,继续滴入的盐酸将溶解所产生的Al(OH)3:
Al(OH)3+3HCl![]() AlCl3+3H2O
AlCl3+3H2O
因1mol Al(OH)3需用3mol HCl才能溶解,所以线段AB∶BN=1∶3。
解:(1)0·02mol OH-离子;(2)随着盐酸的滴入,Al(OH)3沉淀的质量逐渐增加,到M点时,Al(OH)3沉淀质量达最大值;随着盐酸的继续滴入,Al(OH)3沉淀逐渐减少,到N点时,Al(OH)3全部溶解;(3)滴入30mL 盐酸产生0.78g Al(OH)3沉淀,滴入60mL 盐酸,溶液中无Al(OH)3沉淀;(4)[AlO2-]=1mol/L;(5)到点N处滴入的NaOH溶液的体积为60mL。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。课本中出现合金这个科普话题,认点真的学习者自然会想到两个很基本的问题。 1 ,合金...
Fe+nSCN[Fe(SCN)n](3n)+(n=16) 在水溶液中,Fe通常以六水合离子[Fe(H2O)6]形式存在,...
结构不同,一般认为不是同一种物质。 第一:二者结构的区别 ①铝酸 铝酸的化学式为 ,...
合金更完备的定义为:合金是由两种或多种元素组成的物质,其中至少有一种是金属。这些...
铝酸HAlO 铝酸HAlO通常指的就是氢氧化铝Al(OH),它是一种两性氢氧化物,既能与酸反应...
1.冰晶石是如何“助熔”氧化铝的? 氧化铝的熔点太高(2050℃),工业生产中较难获得并...