
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在平衡体系中增大某一反应物的浓度会使平衡向正反应方向移动。但生成物在平衡混合物中的百分含量并不一定增大。因为增大反应物的浓度,必须会使平衡时反应混合物的总物质的量增加。因此生成物在平衡混合物中的百分含量是否增大通过计算作出回答。
例:对于反应CO+H2O(气)![]() CO2+H2。起始时CO,H2O的浓度都是4mol/L,(注起始时只有CO和H2O)达到平衡时H2和CO的浓度为1mol/L,然后将H2O(气)的浓度增至3mol/L,达到平衡时,CO的浓度为0.53mol/L,求两次平衡CO,H2O的转化率,和CO2在平衡混合物中的百分含量。
CO2+H2。起始时CO,H2O的浓度都是4mol/L,(注起始时只有CO和H2O)达到平衡时H2和CO的浓度为1mol/L,然后将H2O(气)的浓度增至3mol/L,达到平衡时,CO的浓度为0.53mol/L,求两次平衡CO,H2O的转化率,和CO2在平衡混合物中的百分含量。
解:第一次平衡过程:
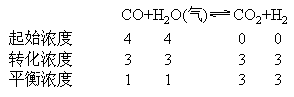
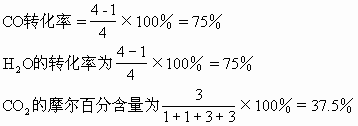
第二次平衡过程:

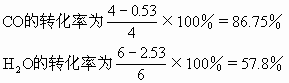
CO2的摩尔百分含量为
![]()
答:略。
通过上面的例题说明当增加反应物H2O(气)的浓度,平衡向正反应方向移动,使另一反应物CO的转化率由75%提高到86.75%(工业上可以利用这一原理采用增大廉价反应物的浓度增加一些贵重原料的利用率),而H2O自身的转化率由75%下降到57.8%。生成物的浓度由3mol/L增加到3.47mol/L。反应中CO2的摩尔百分含量由37.5%降至34.7%。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是能垒、活化能?二者有什么区别? 1、能垒 活化分子含有的能参加化学反应的最低...
1.无论是用某一反应物表示还是用某一生成物表示,由于Δ C 是取浓度变化的绝对值,因...
在一个恒温恒容的密闭容器里,充入2mol SO 2 和1mol O 2 ,发生如下反应并建立化学平...
...
一、人物简介: 阿伦尼乌斯·斯万特·奥古斯特(1859年2月19日~1927年10月2日)瑞典物...
本题考查了阿伦尼乌斯公式中温度和速率常数的关系,即温度升高,速率常数变大。 本题...