
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、表现性质规律
同种元素的多种价态中,其最高价态只具有氧化性,最低价态只具有还原性,处于中间可变价者既具有氧化性又具有还原性。(例略)
二、性质强弱规律
在氧化还原反应中,氧化性强弱的比较是“氧化剂>氧化产物”,还原性的强弱是“还原剂>还原产物”。
1. 判断性质强弱
例1. 根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序为( )。
![]() ;
;
![]() ;
;
![]()
A. ![]()
B. ![]()
C. ![]()
D. ![]()
分析:从题给三反应可知还原性强弱分别有:![]()
![]() ,故
,故![]() 。答案为D。
。答案为D。
2. 判断反应能否发生
例2. 已知![]() 均有还原性,它们在酸性溶液中还原性的强弱顺序为
均有还原性,它们在酸性溶液中还原性的强弱顺序为![]() 。则下列反应不能发生的是( )。
。则下列反应不能发生的是( )。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
分析:假设所给四个选项中的反应都能发生,根据反应方程式可判断出相应的物质的还原性强弱为![]() ,
,![]() 。显然,答案为C、D。
。显然,答案为C、D。
三、反应先后规律
在同时含有几种还原剂、且浓度相差不大的溶液中,若加入氧化剂,则它首先与溶液中最强的还原剂作用(如Cl2通入FeBr2溶液中,Fe2+先被氧化);同理,在同时含有几种氧化剂、浓度相差不大的溶液中,若加入还原剂,则首先与溶液中最强的氧化剂作用(如铁粉加入含![]() 的溶液中,
的溶液中,![]() 先被还原)。
先被还原)。
例3. 在bL FeBr2溶液中通入![]() 时,使溶液中50%的
时,使溶液中50%的![]() 氧化为Br2,则原FeBr2的物质的量浓度为( )
氧化为Br2,则原FeBr2的物质的量浓度为( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
分析:![]() 还原性强于
还原性强于![]() 。向FeBr2溶液中通入Cl2时,氯气先与Fe2+反应,当Fe2+全部被氧化为Fe3+时,再与
。向FeBr2溶液中通入Cl2时,氯气先与Fe2+反应,当Fe2+全部被氧化为Fe3+时,再与![]() 反应。设溶液中FeBr2的物质的量为x。
反应。设溶液中FeBr2的物质的量为x。
![]()
x x/2
![]()
消耗的Cl2的物质的量为x/2+x/2=a mol
故原![]() 的物质的量浓度为a mol/bL=
的物质的量浓度为a mol/bL=![]() 。
。
故答案为C。
四、价态归中(歧化)规律
含不同价态同种元素的物质间发生氧化还原反应时,遵循“高价+底价→中间价”的归中反应规律。此中间价可以相同,也可以不同,但“只靠拢,不错位”。
含同一价态同种元素的物质间发生氧化还原反应时,遵循“中间价→高价+低价”的歧化反应规律。
例4. K35ClO3晶体和含有H37Cl的浓盐酸反应生成氯气,已知反应方程式为![]() +3H2O,此反应生成氯气的摩尔质量为( )
+3H2O,此反应生成氯气的摩尔质量为( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
分析:此氧化还原反应中化合价发生变化的元素是氯元素,双线桥分析如下:
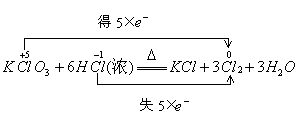
由双线桥分析可知,生成的3个Cl2中6个Cl有5个来自于HCl的37Cl,故氯气的分子量为(5×37+35)/3=73.3g,则氯气的摩尔质量为73.3g·![]() ,答案为B。
,答案为B。
例5. G、Q、X、Y、Z均为含氯的化合物,在一定的条件下具有如下转化关系:
①![]() ,
,
②![]() ,
,
③![]() ,
,
④![]() 。
。
试判断氯的化合价由高到低的排列顺序是( )。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
分析:由①G→NaCl知Cl的化合价降低,则C→Q中Cl的化合价升高,故其中氯的化合价Q>G;由②H2O→H2知H化合价降低,则Q→X中Cl的化合价升高,故X>Q;③中Y发生歧化反应,Y中氯的价态介于G与Q之间,即![]() ;④中Z发生歧化反应,同理,
;④中Z发生歧化反应,同理,![]() 。故答案为D。
。故答案为D。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
1、酸性不同的酸遇同一种碱 当同一溶液中存在多种酸时,若向此溶液中逐滴加入一种碱液...
一、FeBr 2 、FeI 2 溶液与氯气反应的问题 例1、FeBr 2 溶液与氯气反应的问题,有下列...
在溶液中离子是否大量共存的问题是一种常考的选择题型,由于题中条件变化多端,共存情...
离子方程式的正确书写是高中化学教学中的重点内容之一。有很多反应因试剂用量不同而离...
关于一种物质与多种物质发生化学反应时,一定要确定反应的先后顺序,否则,各反应混乱...