
|
学习小专题 |

|
学习小专题 |
 [系列讲座] 元素化合物的重要方程式总结 作者:张德金 来源:高中化学教学研究 日期:2021-05-14 16:03:29 点击:968 所属专题:化学方程式
[系列讲座] 元素化合物的重要方程式总结 作者:张德金 来源:高中化学教学研究 日期:2021-05-14 16:03:29 点击:968 所属专题:化学方程式
一、金属的化学反应 1、钠 (1)Na 2 O 2 与CO 2 反应 。 (2)Na 2 O 2 与SO 2 反应 。 (3)少量Na与CuSO 4 溶液的反应 。 (4)Na 2 CO 3 与AlCl 3 发生双水解反应 。 (5)NaHCO 3 与FeCl 3 发生双水解反应 。 (6)侯氏制碱法的第一步反应为 。 (7)Na 2 CO 3 溶液与CO 2 反应: 。...
 [系列讲座] 有机物的化学性质及主要反应 作者:张德金 来源:高中化学教学研究 日期:2021-05-27 10:31:22 点击:1728 所属专题:有机物化学性质
[系列讲座] 有机物的化学性质及主要反应 作者:张德金 来源:高中化学教学研究 日期:2021-05-27 10:31:22 点击:1728 所属专题:有机物化学性质
一、有机物的燃烧反应 1 、烃的燃烧反应通式: 。 2 、烷的燃烧反应通式: 。 3 、烃的含氧衍生物的燃烧反应通式: 。 二、烃的化学性质 1 、烷:取代反应,分解反应 ( 1 )甲烷与氯气的取代: 。 ( 2 ) C 16 H 34 裂化:(产生汽油) 。 ( 3 ) C 4 H 10 裂解:(...
 [系列讲座] 回归课本:高中化学教材中的一些实验 作者:张德金 来源:高中化学教学研究 日期:2021-05-14 14:13:28 点击:2353 所属专题:实验课本
[系列讲座] 回归课本:高中化学教材中的一些实验 作者:张德金 来源:高中化学教学研究 日期:2021-05-14 14:13:28 点击:2353 所属专题:实验课本
一、无机物的实验 1 、向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯。观察反应的现象和溶液颜色的变化。 现象: 。 解释: 。 2 、过氧化钠与水反应放热。 3 、判断 Na 2 CO 3 和 NaHCO 3 稳定性的套管实验, Na 2 CO 3 放在 中。 4 、焰色反应的...
 [系列讲座] 回归课本:高中化学容易忽略的一些知识 作者:张德金 来源:高中化学教学研究 日期:2021-05-14 14:07:59 点击:1044 所属专题:易错点
[系列讲座] 回归课本:高中化学容易忽略的一些知识 作者:张德金 来源:高中化学教学研究 日期:2021-05-14 14:07:59 点击:1044 所属专题:易错点
必修一 1、阿伏加德罗(A.AVOGaDRO),意大利物理学家,最早提出分子概念,提出了假说(阿伏加德罗定律):在相同的温度和相同压强条件下,。 阿伏加德罗常数并非由阿伏加德罗测量出或计算出,是人们为了纪念他而定。 2、在粒子数目相同的情况下,物质体积的大小取决于构成...
 [系列讲座] 高考经常考查,教材中却没有的一些元素的特殊性质 作者:化学自习室 来源:未知 日期:2021-05-14 10:19:55 点击:1915 所属专题:元素化合物
[系列讲座] 高考经常考查,教材中却没有的一些元素的特殊性质 作者:化学自习室 来源:未知 日期:2021-05-14 10:19:55 点击:1915 所属专题:元素化合物
1、氢H: (1)H,是原子半径最小的元素,有H、D、T三种核素。H 2 、D 2 、HD混合在一起,仍然是纯净物氢气。 (2)H 2 主要体现为还原性,特殊情况下也有氧化性。 与活泼金属加热反应,得到金属氢化物,显示H 2 有氧化性。与Ca的反应为: Ca+H 2 =Δ=CaH 2 。 (3)金属氢化物与...
 [系列讲座] 高考常考查的教材中没有的有机反应 作者:张德金 来源:高中化学教学研究 日期:2021-05-11 16:42:25 点击:2169 所属专题:有机合成信息
[系列讲座] 高考常考查的教材中没有的有机反应 作者:张德金 来源:高中化学教学研究 日期:2021-05-11 16:42:25 点击:2169 所属专题:有机合成信息
(C 6 HX - 表示苯环) 1、酸性KMnO 4 氧化:(有机物的氧化反应和还原反应中,有机物中增加一个O或减少两个H都失去两个电子) (1)产物为CO 2 。(含一个碳的有机物或断键后为一个碳的) 如CH 3 OH、HHO、HCOOH、CH 2 =CH 2 、CH≡CH、RCH=CH 2 (其中一个产物)、RC≡CH(其中...
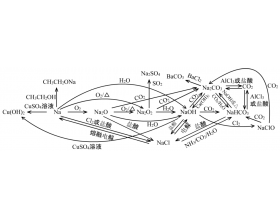 [系列讲座] 一轮复习讲座:一、利用元素化合物的相互转化图像快速复习 作者:张德金 来源:高中化学教学研究 日期:2021-04-22 16:56:29 点击:802 所属专题:元素化合物
[系列讲座] 一轮复习讲座:一、利用元素化合物的相互转化图像快速复习 作者:张德金 来源:高中化学教学研究 日期:2021-04-22 16:56:29 点击:802 所属专题:元素化合物
(一)金属部分 一、如何复习无机物质的化学性质 1、复习无机物质的化学性质,主要从五个方面入手: (1)分析它的强氧化性或强还原性,对应的化学反应为氧化还原反应。 如金属单质的还原性,非金属单质的氧化性或还原性,H 2 S(HS - 、 S 2 - )、SO 2 (Hs O 3 - 、S O 3...
 [系列讲座] 第一讲:学会无机物质的化学性质的方法 作者:张德金 来源:高中化学教学研究 日期:2021-04-21 15:46:40 点击:466 所属专题:化学性质
[系列讲座] 第一讲:学会无机物质的化学性质的方法 作者:张德金 来源:高中化学教学研究 日期:2021-04-21 15:46:40 点击:466 所属专题:化学性质
要想真正学懂化学,需要学会物质的化学性质。而物质的化学性质又体现为一个个化学方程式,所以通过化学方程式来学会物质的化学性质,是非常重要的一种方法。 1、化学方程式不仅是一个方程式,更体现的是物质的化学性质。 (1)如NaHCO 3 的两个例子, NaHCO 3 +HCl=NaCl+H 2...
 [系列讲座] 第二讲:单质的化学性质(一)金属单质 作者:张德金 来源:高中化学教学研究 日期:2021-04-22 08:04:37 点击:2782 所属专题:化学性质 金属及其化合物
[系列讲座] 第二讲:单质的化学性质(一)金属单质 作者:张德金 来源:高中化学教学研究 日期:2021-04-22 08:04:37 点击:2782 所属专题:化学性质 金属及其化合物
单质分为金属单质与非金属单质。除个别特殊情况之外,单质一般参加的是氧化还原反应,对应的化学性质是还原性或氧化性。 在分析常见的金属与非金属的性质之前,还需要知道它们的金属性或非金属性的能力顺序。金属的金属性的依次排列顺序为 N A 、Mg、Al、Zn、Fe、Cu、Ag...
 [系列讲座] 第三讲:单质的化学性质(二)非金属单质 作者:张德金 来源:高中化学教学研究 日期:2021-04-22 08:05:09 点击:1705 所属专题:非金属及其化合物 化学性质
[系列讲座] 第三讲:单质的化学性质(二)非金属单质 作者:张德金 来源:高中化学教学研究 日期:2021-04-22 08:05:09 点击:1705 所属专题:非金属及其化合物 化学性质
常见的非金属单质有O 2 、Cl 2 、N 2 、S、C、H 2 等。非金属单质参加的一般是氧化还原反应。有的非金属单质主要体现还原性,有的主要体现氧化性,而有的两种性质都有体现,又都不强。而且产物的形态各有不同。 1、还原性为主的非金属的化学性质,如C、H 2 。 体现为还...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。78 号铂 Pt 、 79 号金 Au 、 80 号汞 Hg 、 82 号铅 Pb 、 92 号铀 U 。 一、铂 78 P...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...
一、氢 H 1 、 H ,是原子半径最小的元素,有 H (氕)、 D (氘)、 T (氚)等核素...
一、钠Na 大量存在于海水中,矿物主要有钠长石NaAlSi3O8、岩盐NaCl、钠硝石NaNO3等。 ...
一、硫S 1、H2S有臭鸡蛋气味。 (1)是二元弱酸,与NaOH能生成两种盐NaHS、Na2S。 (2...