
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、硫S
1、H2S有臭鸡蛋气味。
(1)是二元弱酸,与NaOH能生成两种盐NaHS、Na2S。
(2)H2S、硫化物盐都有强还原性。
H2S能燃烧。
2H2S+3O2(足量)=点燃=2H2O+2SO2
2H2S+O2(少量)=点燃=2H2O+2S↓
Na2S+Cl2=2NaCl+S↓
(3)H2S+CuSO4=CuS↓+H2SO4
除去溶液中的重金属离子,一般用H2S或可溶性硫盐。
(4)检验H2S气体
用湿润的蓝色CuSO4试纸,现象是试纸变黑。
(5)多硫化物
Na2Sx(x≥2),x越大,溶液颜色越深,无-黄-橙-红。
单质S溶于硫化物盐溶液。
Na2S+(x-1)S= Na2Sx
多硫化物与酸能反应。
Na2Sx+2HCl=2NaCl+H2S↑+(x-1)S↓
2、S,淡黄色固体,难溶于水,微溶于酒精,易溶于CS2。

(1)还原性
S+O2=点燃=SO2
S+2H2SO4(浓)=Δ=3SO2↑+2H2O
5S+6KMnO4+4H2SO4=3K2SO4+6MnsO4+4H2O
(2)氧化性,氧化性不强,生成低价金属硫化物。
Fe+S=Δ=FeS
2Cu+S=Δ=Cu2S
H2+S=Δ=H2S
(3)与NaOH溶液反应
3S+6NaOH=2Na2S+Na2SO3+3H2O
(4)黑火药(一硫二硝三炭)
S+2KNO3+3C=K2S+N2↑+3CO2↑
3、SO2,无色有刺激性气味的气体,易溶于水(体积比1:40)。
(1)酸性氧化物,对应的酸是H2SO3(亚硫酸),在复分解反应现象上与CO2相似。
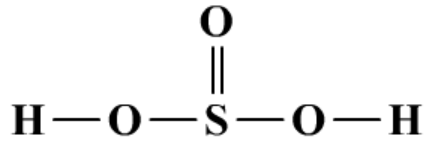
通入澄清石灰水、Ba(OH)2溶液等,都出现先变浑浊,后变澄清的现象。CaSO3、BaSO3难溶于水,Ca(HSO3)2、Ba(HSO3)2溶于水。
(2)SO2和亚硫酸盐都有强还原性。
2SO2+O2⇌催化剂/加热⇌2SO3
SO2+Cl2+2H2O=H2SO4+2HCl
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
亚硫酸盐在空气中都易被氧化。
2Na2SO3+O2=2Na2SO4
(3)SO2有氧化性。
SO2+2H2S=3S↓+2H2O
5SO2(过量)+2Na2S+2H2O=3S↓+4NaHSO3
(4)SO2有漂白性,能漂白品红溶液,漂白效果不稳定,加热后又变为红色。
不能漂白紫色石蕊试液,只能使其变红。

4、SO3,标准状况下是固体,常温常压下是液体,温度稍高时是气体(大于44.8℃)。
(1)分子结构为平面正三角形。有大л键,为Π46。
(2)酸性氧化物,对应的酸是H2SO4。遇水生成硫酸。
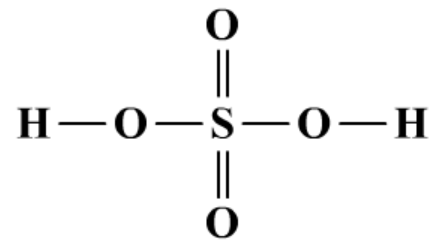
SO3+H2O=H2SO4
CaO+SO3=CaSO4
(3)SO3有强氧化性。
2SO3+S=Δ=3SO2
SO3+Zn=Δ=ZnO+SO2
5、H2SO4,有发烟硫酸(溶解SO3)、纯硫酸、浓硫酸(98.3%)、稀硫酸。
难挥发,稳定。稀硫酸的氧化性很弱,浓硫酸的氧化性很强。
(1)强酸性。与碱性氧化物、碱、弱酸盐等反应。
(2)浓硫酸有吸水性,可用作干燥剂。但由于有强氧化性,不能干燥H2S、HI、HBr等气体。
(3)有脱水性。
C6H12O6=浓硫酸=6C+6H2O
(3)有强氧化性。(浓)
Cu+2H2SO4(浓)=Δ= CuSO4+SO2↑+2H2O
C+2H2SO4(浓)=Δ= CO2↑+SO2↑+2H2O
6、盐:
(1)硫酸盐,比较稳定,多数在一般受热下不易反应。
温度高时,会发生分解。
MgSO4=Δ=MgO+SO3↑
若金属离子有强还原性,则可能发生氧化还原反应。
2FeSO4=Δ=Fe2O3+SO2↑+SO3↑
检验溶液中的SO42-:先加盐酸,再加BaCl2。
(2)硫代硫酸及盐
Na2S2O3硫代硫酸钠,叫海波、大苏打,遇强酸发生歧化反应。
Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O。
有强还原性,经常用来测定溶液中的碘单质含量。
I2+2Na2S2O3=2NaI+ Na2S4O6。(连四硫酸钠)
用亚硫酸钠和S制取。
Na2SO3+S=沸腾=Na2S2O3
(3)焦硫酸H2S2O7及盐K2S2O7
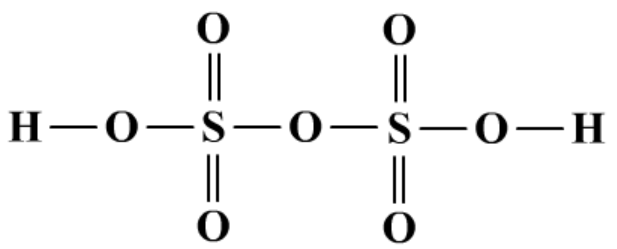
H2SO4+SO3=H2S2O7
焦硫酸比硫酸有更强的氧化性,吸水性和腐蚀性。
H2S2O7+H2O=2H2SO4
K2S2O7的主要功能是熔矿。
2KHSO4=Δ=K2S2O7+H2O
3K2S2O7+Fe2O3=3K2SO4+Fe2(SO4)3
(4)过二硫酸及盐(有过氧键)
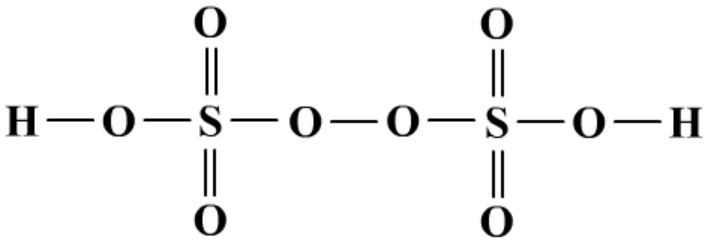
有强氧化性。
5K2S2O8+2MnSO4+8H2O=Ag=4K2SO4+2KMnO4+8H2SO4
不稳定。
2K2S2O8=Δ=2K2SO4+2SO3↑+O2↑
(5)连二亚硫酸及盐
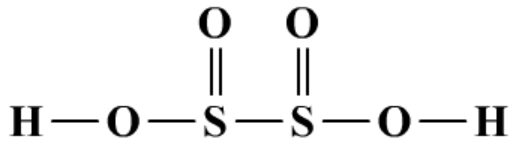
强还原性。
2Na2S2O4+O2+2H2O=4NaHSO3
常用于染料工业上的还原剂,二水合物俗称保险粉。
Na2S2O4+2CuCl=2NaCl+2Cu+2SO2↑
不稳定。
2H2S2O4+H2O=3H2SO3+S↓
(6)连硫酸及盐,通式H2SxO6。
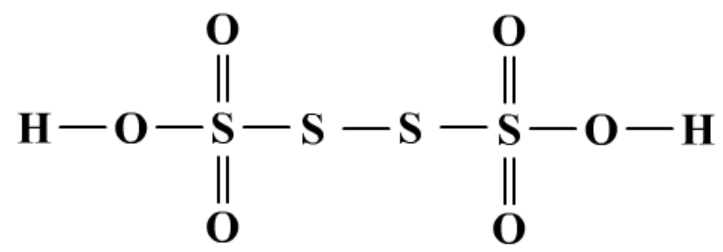
连四硫酸
Na2S4O6,连四硫酸钠。
7、含氧酸衍生物
(1)亚硫酰氯SOCl2,无色液体,遇水剧烈水解。
SOCl2+H2O=SO2↑+2HCl
可用作原电池的非水电解质,用于易水解的水合金属氯化物脱水和金属氧化物的氯化。
MgCl2·6H2O+SOCl2=Δ=MgCl2+5H2O+SO2↑+2HCl↑
(2)硫酰氯SO2Cl2,无色液体,遇水剧烈水解。
SO2Cl2+2H2O= H2SO4+2HCl
二、氯Cl
1、氯气,黄绿色气体,有刺激性气味,有毒。少量溶于水(体积比1:2)。
(1)与金属、非金属反应。
3Cl2+2Fe=点燃=2FeCl3
Cl2+2Cu=点燃=CuCl2
Cl2+H2=点燃=2HCl
(2)溶于水时,少量与水反应。
Cl2+H2O=HCl+HClO
(3)与还原性酸反应
Cl2+2HI=I2+2HCl
(4)与碱反应。
Cl2+2NaOH=NaCl+NaClO+H2O
加热时,生成NaClO3。
3Cl2+6NaOH=Δ=5NaCl+NaClO3+3H2O
(5)与还原性盐反应。
Cl2+Na2SO3+H2O=Na2SO4+2HCl
Cl2+2NaBr=Br2+2NaCl
Cl2+2KI=I2+2NaCl
(6)用于自来水的消毒。
氯水
2、HCl
(1)水溶液叫盐酸,气态叫氯化氢。
(2)盐酸是强酸。与活泼金属、碱性氧化物、碱、弱酸盐等反应。
(3)易挥发。
2NaCl+H2SO4=Δ=2HCl↑+Na2SO4
(4)盐酸有一定的还原性。
4HCl(浓)+MnO2=Δ=MnCl2+Cl2↑+2H2O(实验室制取氯气)
16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O(实验室制取氯气)
3、HClO及次氯酸盐
(1)次氯酸,只存在于水溶液中。
(2)次氯酸比碳酸弱。
NaClO+CO2+H2O=NaHCO3+HClO
(3)次氯酸不稳定。
2HClO=光照=2HCl+O2↑
(4)有强氧化性,有漂白性。
HClO+Na2SO3=HCl+Na2SO4
NaClO+Na2SO3=NaCl+Na2SO4
(5)漂白液和漂白粉
漂白液:氯气与NaOH溶液反应得到的溶液,主要溶质是NaClO和NaCl。
漂白粉:氯气与Ca(OH)2反应得到的固体,主要成分是Ca(ClO)2和CaCl2。
漂白粉在空气中失效:Ca(ClO)2与空气中的CO2、H2O生成HClO,HClO见光分解。
4、其它含氧酸及盐
(1)高氯酸及盐在水溶液中氧化性较弱,原因是氯被呈正四面体的四个氧包围,不容易得到电子。
但在固体的高温反应中,高氯酸盐有很强的氧化性。因为它们极易分解出大量高活性的氧原子。
(2)氯酸及盐、亚氯酸及盐,在酸性溶液中都有强氧化性。能将氯离子氧化为氯气。它们的盐在高温下也有强氧化性。
NaClO3+5NaCl+3H2SO4=3Cl2↑+3Na2SO4+3H2O
5、检验氯离子
先加稀HNO3,再加AgNO3,若有白色沉淀,则有氯离子。
6、工业制取氯气
电解饱和食盐水:2NaCl+2H2O=电解=2NaOH+H2↑+Cl2↑
三、钾K
含K的一些物质,硝石(KNO3)、明矾(KAl(SO4)2·12H2O)、草木灰(K2CO3)、光卤石(KCl·MgCl2·6H2O)、钾长石K[AlSi3O8]。
1、活泼金属,密度小于水,质软,比钠活泼。
(1)在空气中点燃生成K2O2、KO2(超氧化钾)。
(2)遇水反应比钠更剧烈。
(3)溶于液氨。
K+NH3=K+[NH3]-=KNH2+1/2H2
2、K2O是碱性氧化物,遇水完全反应生成KOH,KOH是强碱。
3、钾盐可以用于农作物的肥料。
(1)多数钾盐在水中的溶解度比相似的钠盐大。
(2)KClO4、KIO4难溶于水。
(3)KNO3、KClO3、KMnO4可以用作炸药。钾盐与钠盐比,不易吸潮。
(4)检验钾离子:利用焰色试验,呈紫色,需透过蓝色钴玻璃观察。
4、制取钾金属,用电解熔融KCl。
四、Ca
含钙矿物有石灰石CaCO3、白云石CaCO3·MgCO3、石膏CaSO4·2H2O、萤石CaF2、磷灰石Ca5(PO4)3F等。
1、钙,银白色金属,
在空气中表面上能形成一层氧化物或氮化物薄膜,可减缓进一步腐蚀。
加热时与大多数非金属直接反应,如与氟、氯、溴、碘、硫、氮、碳、氢反应生成卤化钙、硫化钙CaS、氮化钙Ca3N2、碳化钙CaC2和氢化钙CaH2,加热时与二氧化碳反应。
常温下跟水反应生成氢氧化钙并放出氢气。
Ca+2H2O =Ca(OH)2+H2↑
加热时几乎能还原所有金属氧化物,在熔融时也能还原许多金属氯化物。
2、CaO,生石灰,可做干燥剂,可以制熟石灰Ca(OH)2,用于建筑材料。
3、Ca(OH)2,熟石灰,强碱,微溶,可以用来制NaOH等。
Ca(OH)2+Na2CO3=CaCO3+2NaOH
3、CaCl2:吸水能力强,可做干燥剂。
CaSO4:CaSO4·2H2O叫生石膏,2CaSO4·H2O叫熟石膏,用于制作雕塑,也可以用来添加到水泥中调节硬化速度。
4、CaCO3:又叫石灰石、大理石、方解石、白垩等,是重要的建筑材料,也是骨骼的主要成分。
高温分解后用于制CaO和Ca(OH)2。
CaCO3=高温=CaO+CO2↑
5、CaC2:电石,可以制乙炔。
CaC2+2H2O =Ca(OH)2+C2H2↑
6、暂时硬水的软化方法是加热法。方程式为Ca(HCO3)2=Δ=CaCO3+H2O +CO2↑。
永久硬水的常用软化方法是离子交换法。
7、制取钙金属,主要方法是电解熔融CaCl2。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...