
|
学习小专题 |

|
学习小专题 |
 [元素化合物] 氧化性酸:浓硝酸和浓硫酸比较 作者:化学自习室 来源:未知 日期:2023-01-02 10:56:20 点击:1848 所属专题:氧化性酸
[元素化合物] 氧化性酸:浓硝酸和浓硫酸比较 作者:化学自习室 来源:未知 日期:2023-01-02 10:56:20 点击:1848 所属专题:氧化性酸
在常见的酸中,无论酸性,还是氧化性,浓硝酸和浓硫酸可以称得上是酸中“双雄”了。这两种酸有哪些异同点呢? 一、二者都具有强氧化性 浓硫酸中+6价的S原子和浓硝酸中+5价的 n (原子均为最高价),都具有很强的氧化性,可以夺取许多物质中的电子,因此二者具有强氧化性。主...
 [元素化合物] 常见物质及其用途 作者:化学自习室 来源:未知 日期:2022-12-12 15:43:29 点击:363 所属专题:物质性质及用途
[元素化合物] 常见物质及其用途 作者:化学自习室 来源:未知 日期:2022-12-12 15:43:29 点击:363 所属专题:物质性质及用途
序号 物质 用途 1 O 3 ① 漂白剂 ② 消毒剂 2 Cl 2 ① 杀菌消毒 ② 制盐酸、漂白剂 ③ 制氯仿等有机溶剂和多种农药 3 N 2 ① 焊接金属的保护气 ② 填充灯泡 ③ 保存粮食作物 ④ 冷冻剂 4 白磷 ① 制高纯度磷酸 ② 制烟幕弹和燃烧弹 5 红磷 制安全火柴、农药等 6 Na ① 制 Na...
 [元素化合物] 缤纷多彩的化学现象 作者:化学自习室 来源:未知 日期:2022-12-12 10:16:54 点击:339 所属专题:化学现象
[元素化合物] 缤纷多彩的化学现象 作者:化学自习室 来源:未知 日期:2022-12-12 10:16:54 点击:339 所属专题:化学现象
第一部分 金属的性质 锂的反应 原理:这是金属锂燃烧的景象,燃烧过程中固态的金属锂不断熔化,并生成氧化锂。锂的焰色反应为红色,但当剧烈燃烧时火焰呈现一种“亮银色”的状态。 钠与水反应 钠属于碱金属元素,钠原子最外层只有一个电子,非常容易失去,所以显示出非...
 [元素化合物] 重要的元素化合物化学方程式总结 作者:化学自习室 来源:未知 日期:2022-08-04 16:38:35 点击:715 所属专题:元素化合物
[元素化合物] 重要的元素化合物化学方程式总结 作者:化学自习室 来源:未知 日期:2022-08-04 16:38:35 点击:715 所属专题:元素化合物
一、碱金属 1.钠露置在空气中变暗: 4Na + O 2 = 2Na 2 O 2.钠的燃烧 ( 工业生产过氧化钠 ) : 2Na + O 2 Na 2 O 2 3.钠与硫混合爆炸: 2Na + S = Na 2 S 4. 钠投入水中: 2Na + 2H 2 O = 2NaOH + H 2 ↑ 5.钠投入硫酸铜溶液中: 2Na + CuSO 4 + 2H 2 O = Na 2 SO ...
 [元素化合物] 高中化学互滴法的现象总结 作者:化学自习室 来源:未知 日期:2022-08-04 10:27:06 点击:235 所属专题:互滴
[元素化合物] 高中化学互滴法的现象总结 作者:化学自习室 来源:未知 日期:2022-08-04 10:27:06 点击:235 所属专题:互滴
...
 [元素化合物] 五花八门的水解反应 作者:化学自习室 来源:未知 日期:2022-08-03 17:58:21 点击:1168 所属专题:水解反应
[元素化合物] 五花八门的水解反应 作者:化学自习室 来源:未知 日期:2022-08-03 17:58:21 点击:1168 所属专题:水解反应
水解反应:某物质与水电离出的离子或水分子的基团发生交换的反应。 一、无机物的水解 1.单质的水解: Cl-Cl+H-OH == HCl + HClO 2.氧化物的水解: Na 2 O + H-OH == 2NaOH 3.盐类的水解: 化学反应原理:盐的离子(一般是弱酸的阴离子或弱碱的阳离子)跟水电离出...
 [元素化合物] 常见化学气体性质总结 作者:化学自习室 来源:未知 日期:2022-08-02 17:33:37 点击:575 所属专题:常见气体
[元素化合物] 常见化学气体性质总结 作者:化学自习室 来源:未知 日期:2022-08-02 17:33:37 点击:575 所属专题:常见气体
1.常见气体的溶解性: 极易溶:NH 3 ,HCl; 易溶:HX,HHO,NO 2 ,SO 2 ; 能溶,可溶:CO 2 ,Cl 2 ,H 2 S,Br 2 ; 微溶:C 2 H 2 ; 难溶,不溶:O 2 ,H 2 ,CO,NO,CH 4 ,CH 3 Cl,C 2 H 4 ,C 2 H 6 ; 与水反应:F 2 ,NO 2 ,Cl 2 ,Br 2 ,CO 2 ,SO 2 ,NH 3...
 [元素化合物] 能使高锰酸钾溶液褪色的物质总结 作者:化学自习室 来源:未知 日期:2022-07-31 18:40:28 点击:4280 所属专题:高锰酸钾
[元素化合物] 能使高锰酸钾溶液褪色的物质总结 作者:化学自习室 来源:未知 日期:2022-07-31 18:40:28 点击:4280 所属专题:高锰酸钾
导 语 高锰酸钾(Potassium permanganate),是一种强氧化剂,为黑紫色、细长的棱形结晶或颗粒,带蓝色的金属光泽,无臭,与某些有机物或易氧化物接触,易发生爆炸,溶于水、碱液,微溶于甲醇、丙酮、硫酸,分子式为KMnO4,分子量为158.034。熔点为240°C,但接触易燃材...
 [元素化合物] 能使溴水褪色的物质总结 作者:化学自习室 来源:未知 日期:2022-07-31 18:34:50 点击:1933 所属专题:溴水
[元素化合物] 能使溴水褪色的物质总结 作者:化学自习室 来源:未知 日期:2022-07-31 18:34:50 点击:1933 所属专题:溴水
导语 : 溴水一般指溴单质与水的混合物。 溴单质微溶于水,80%以上的溴会与水反应生成氢溴酸与次溴酸,但仍然会有少量溴单质溶解在水中,所以溴水呈 橙黄色 。新制溴水可以看成是溴的水溶液,进行与溴单质有关的化学反应,但时间较长的溴水中溴分子也会分解,溴水逐渐褪...
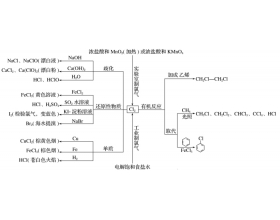 [元素化合物] 回扣“9种”核心物质的性质及应用 作者:化学自习室 来源:未知 日期:2022-05-27 09:54:28 点击:364 所属专题:元素化合物
[元素化合物] 回扣“9种”核心物质的性质及应用 作者:化学自习室 来源:未知 日期:2022-05-27 09:54:28 点击:364 所属专题:元素化合物
物质1 氯气(黄绿色刺激性有毒气体) 物质2 二氧化硫(无色刺激性有毒气体) 物质3 硫酸(高沸点、难挥发性强酸) 物质4 氨气(无色刺激性气体) 物质5 硝酸(无色易挥发性强酸) 物质6 二氧化硅(熔点高、硬度大、不溶于水的酸性氧化物) 物质7 (碳酸钠和碳酸氢钠) 物质8 铝的化合物...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...