
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 例析电解质溶液中水电离出的氢离子浓度 作者:刘 鸿 来源:摘抄于因特网 日期:2018-07-19 17:02:09 点击:13002 所属专题:水电离氢离子浓度
[注解与辨疑j] 例析电解质溶液中水电离出的氢离子浓度 作者:刘 鸿 来源:摘抄于因特网 日期:2018-07-19 17:02:09 点击:13002 所属专题:水电离氢离子浓度
例析电解质溶液中水电离出的c(H + ) 水 和c(OH - ) 水 云南省富源县第二中学 655508 刘 鸿 对于任何一种电解质的水溶液,在一定温度下,水电离出的c(H + ) 水 和c(OH - ) 水 一定相等,溶液中c(H + ) 溶液 与c(OH - ) 溶液 的乘积为一常数,写作:Kw=c(H + ) 溶液 · c...
 [探讨与扩展3] 在水溶液中K值大于1为强酸 作者:邬兆宇 来源:摘抄于因特网 日期:2022-08-06 17:08:15 点击:7414 所属专题:酸性 电离平衡常数
[探讨与扩展3] 在水溶液中K值大于1为强酸 作者:邬兆宇 来源:摘抄于因特网 日期:2022-08-06 17:08:15 点击:7414 所属专题:酸性 电离平衡常数
HI 10 11 HBr 10 9 HCl 10 7 HClO 4 10 7 HClO 3 10 3 H 2 SO 4 10 2 HNO 3 20 H 3 O + 1 C 2 H 2 O 4 (草酸 ) 5.4*10 -2 HSO 4 - 10 -2 H 3 PO 4 6.7*10 -3 [Fe(H 2 O) 6 ] 2+ 7.7*10 -3 HNO 2 6.0*10 -4 HCOOH 1.8*10 -4 HN 3 2.4*10 -5 CH 3 COOH 1.8*10 -5 H 2 CO 3...
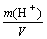 [注解与辨疑j] 强电解质和弱电解质的同与不同 作者:向小平 来源:摘抄于因特网 日期:2022-08-05 17:54:02 点击:26794 所属专题:弱电解质
[注解与辨疑j] 强电解质和弱电解质的同与不同 作者:向小平 来源:摘抄于因特网 日期:2022-08-05 17:54:02 点击:26794 所属专题:弱电解质
一、 强、弱电解质概念上的四大区别 强电解质在水溶液中全部电离,电离不可逆,不存在电离平衡,溶液中不存在电解质的分子,只有电解质的离子;其电离方程式写等号,在离子方程式中可溶的强电解质写离子符号。弱电解质在水溶液中只有很少部分电离,电离可逆,存在电离...
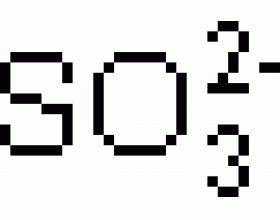 [注解与辨疑j] 关于水电离的问题集 作者:李从山 来源:摘抄于因特网 日期:2016-02-02 22:20:40 点击:17764 所属专题:水的电离
[注解与辨疑j] 关于水电离的问题集 作者:李从山 来源:摘抄于因特网 日期:2016-02-02 22:20:40 点击:17764 所属专题:水的电离
水是一种极弱的电解质,在常温下能电离出极少量的H + 和OH - ,存在着电离平衡, 在解答有关水电离的问题时,要掌握以下的知识和规律。 1. K w = c (H + ) c (OH - )。由于水中 c (H + )= c (OH - ),纯水总是中性的。 2. 不能认为 c (H + )或 c (OH - )等于10 -7 m...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由...
多元弱酸是分步电离的,且以第一步电离为主,各级电离常数逐级减少,且相差很大。 对...
过渡金属具有多变的氧化数,因为次外层d电子可以部分或者全部参与成键,因此它们能形...
问:为什么强酸在冰醋酸中可以比较出其酸性强弱? 想要回答这个问题,还是得回到酸电...