
|
学习小专题 |

|
学习小专题 |
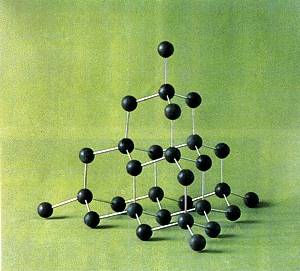 [注解与辨疑z] 物质的稳定性、活泼性、键能和内能之间的关系 作者:林夕 来源:未知 日期:2016-03-20 15:28:06 点击:9995 所属专题:能量观 稳定性 键能
[注解与辨疑z] 物质的稳定性、活泼性、键能和内能之间的关系 作者:林夕 来源:未知 日期:2016-03-20 15:28:06 点击:9995 所属专题:能量观 稳定性 键能
化学必修2第二专题第二单元化学反应中的能量变化 一节内容的授课中,关于物质的能量以及物质的稳定性和物质内部键能之间的关系在教材中没有明确地阐述。按照课本内容去讲述,学生的理解会出现问题,他们认为键能越大,物 质越活泼,这种物质的能量越高,这种想法的学生是非...
 [注解与辨疑h] 化学变化过程中一定会有能量的变化吗? 作者:安勃 来源:未知 日期:2019-07-29 20:44:19 点击:11376 所属专题:化学反应与能量变化
[注解与辨疑h] 化学变化过程中一定会有能量的变化吗? 作者:安勃 来源:未知 日期:2019-07-29 20:44:19 点击:11376 所属专题:化学反应与能量变化
化学变化过程中一定会有能量的变化吗?理由是什么?对于基元反应也一定有能量变化吗? (备注:基元反应本身是指没有中间产物,一步完成的反应)有没有焓变为零的化学反应呢? 解析: 一定。 能量变化是反应的动力之一。 化学变化是旧键短裂(须吸收能量)、新键形成(...
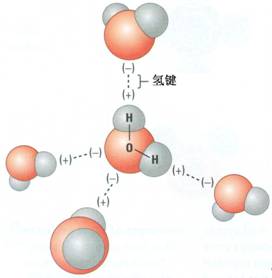 [注解与辨疑h] 放热和吸热的经验规则 作者:田兴虎 来源:未知 日期:2015-12-11 19:46:43 点击:1281 所属专题:放热反应 吸热反应
[注解与辨疑h] 放热和吸热的经验规则 作者:田兴虎 来源:未知 日期:2015-12-11 19:46:43 点击:1281 所属专题:放热反应 吸热反应
一般情况下,解离的反应是吸热的,如分解、离解(电离)、水解、电解等,反之,合的反应放热,如化合、结合(离子结合成气体、沉淀、弱电解质)等。 作为氧化还原反应,氧化性还原性强的物质之间反应生成氧化性还原性弱的物质都是放热的,反之是吸热的。...
 [注解与辨疑h] 与燃烧有关的问题集 作者:林夕 来源:未知 日期:2015-12-11 19:47:54 点击:602 所属专题:燃烧
[注解与辨疑h] 与燃烧有关的问题集 作者:林夕 来源:未知 日期:2015-12-11 19:47:54 点击:602 所属专题:燃烧
一、概念:燃烧是指可燃物与氧气发生的一种发光放热的剧烈的氧化反应。 二、燃烧的三个条件:物质具有可燃性,可燃物与氧气(或空气)接触,温度达到可燃物的着火点 三、 促进物质燃烧的方法: (1)增大氧气的浓度; (2)增大可燃物与氧气的接触面积 四、 对燃烧概念...
 [注解与辨疑h] ΔH符号正负与放热吸热关系形象比喻 作者:汪军 来源:未知 日期:2016-01-31 20:12:17 点击:18614 所属专题:焓变
[注解与辨疑h] ΔH符号正负与放热吸热关系形象比喻 作者:汪军 来源:未知 日期:2016-01-31 20:12:17 点击:18614 所属专题:焓变
学生对于热化学中的吸热反应和放热反应中能量变化情况不是十分清楚,往往对于吸热反应 Δ H 大于 0 ,而放热反应 Δ H 小于 0 ,放热反应和吸热反应中反应物与生成物的能量大小关系等问题一知半解,容易弄混乱。为了让学生简单形象的弄清这些问题,我在教学中作了以下类...
 [注解与辨疑h] 焓到底是什么? 作者:孙法军 来源:未知 日期:2014-09-04 16:41:34 点击:737 所属专题:焓变
[注解与辨疑h] 焓到底是什么? 作者:孙法军 来源:未知 日期:2014-09-04 16:41:34 点击:737 所属专题:焓变
...
 [注解与辨疑h] 热化学方程式正误判断及盖斯定律应用 作者:鲁群 来源:未知 日期:2016-01-31 20:18:04 点击:1843 所属专题:热化学方程式 盖斯定律
[注解与辨疑h] 热化学方程式正误判断及盖斯定律应用 作者:鲁群 来源:未知 日期:2016-01-31 20:18:04 点击:1843 所属专题:热化学方程式 盖斯定律
一、热化学方程式的检查方法-------“四查” 查状态 查正负号 查单位 查匹配 三、盖斯定律的应用----关键是目标方程式的“四则运算式”的导出。 同类物质(同为反应物或同为生成物),反应热相加;不同类物质(一个为反应物与一个为生成物,反应热相减;反应方向倒转后...
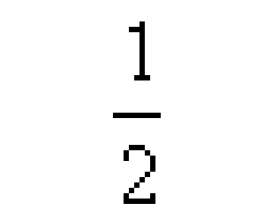 [注解与辨疑h] 热化学方程式的重点剖析 作者:柳正红 来源:未知 日期:2016-01-31 20:20:00 点击:7536 所属专题:热化学方程式
[注解与辨疑h] 热化学方程式的重点剖析 作者:柳正红 来源:未知 日期:2016-01-31 20:20:00 点击:7536 所属专题:热化学方程式
H 2 ( g ) +1∕2O 2 ( g ) =H 2 O ( l ) △ H ( 298K ) = - 285.8KJ·mol - 1 ,此反应不仅表示了物质的变化,还表示了反应的焓变,此方程式为热化学方程式。 1 、热化学方程式概念:在热化学中,将化学反应中物质的变化和反应的焓变同时表示出来的化学方程式...
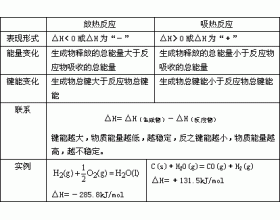 [注解与辨疑h] 化学反应放热或吸热的判断 作者:刘学超 来源:未知 日期:2016-01-31 20:26:07 点击:9555 所属专题:放热反应 吸热反应
[注解与辨疑h] 化学反应放热或吸热的判断 作者:刘学超 来源:未知 日期:2016-01-31 20:26:07 点击:9555 所属专题:放热反应 吸热反应
1、根据具体化学反应实例判断 (1)常见的放热反应:所有可燃物的燃烧、所有金属与酸的反应、所有中和反应、绝大多数化合反应、少数分解反应、多数置换反应、铝热反应、某些复分解反应。典型反应: (2)常见的吸热反应:极个别的化合反应(CO 2 和C的反应)、绝大多数...
 [注解与辨疑h] 化学反应的反应热与键能的关系 作者:张瀚 来源:未知 日期:2018-10-08 20:57:22 点击:23077 所属专题:反应热计算 键能
[注解与辨疑h] 化学反应的反应热与键能的关系 作者:张瀚 来源:未知 日期:2018-10-08 20:57:22 点击:23077 所属专题:反应热计算 键能
新教材中关于反应热的定义与旧教材相比,更为科学合理。但由于旧教材的影响,不管是在新教材的教学过程中,还是在众多的参考资料上,都存在着各种各样模糊甚至是错误的观点。例如,在全国影响较大的志鸿优化设计新版高三复习资料上,化学反应的热效应 H =生成物的键能总...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。化学反应热力学和动力学的区别与联系如下: 一、热力学和动力学区别 1. 研究对象 热力...
一、概念梳理 中和热是指在稀溶液中,酸与碱发生中和反应生成1 mol 水时的反 应热.在2...
1.焓是什么?与什么因素有关?物质的具体焓值是否可测? 焓(符号H)是一个很难说清楚其...
...
第一阶段:离子反应发生的条件是要有沉淀、气体、水生成; 第二阶段:离子反应发生的...
反应热 当化学反应在一定温度下进行时,反应所释放或吸收的热量称为该反应此温度下的...
高中热化学中的反应进度: 化学反应的焓变:化学反应过程中所释放或吸收的能量,都可...
1、焓是什么?与什么因素有关?物质的具体焓值是否可测? 焓(符号H)是一个很难说清楚...