
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、诱导效应和共效应
诱导效应:一般存在于σ键中,通过原子间电负性的差异而导致键的极性改变,从而使整个分子电子云发生移动。诱导效应属于短距离效应,一般传递3个碳原子后基本消失,其极化变化方向单一。
烷基的诱导作用强弱规律是:碳链越长,给电子的诱导作用越强。
共轭效应:一般存在于共轭体系中,通过Π电子的运动,沿着共轭链传递,强度一般不因共轭链的长度而受影响。共轭效应属于长距离电子效应,极性交替出现。
二、-COOH表现酸性的原因
碳酸和甲酸、乙酸、苯甲酸等为什么会具有酸性?

第四版《基础有机化学》上册北京大学邢其毅编P.525
羧酸都具有酸性,因为:
①氧的电负性大于氢,氢氧键的电子云偏向于氧;
②氢离去后形成的羧酸根负离子因为离域使电荷分散,反而更加稳定。
注:
①多数的羧酸是弱酸,一元饱和脂肪族羧酸pKa值一般在3~5;
②羧酸根负离子越稳定,也就越容易生成,酸性就越强;
③除了电子效应外,也要考虑空间效应及氢键的影响。
碳酸H2CO3可看作:HO-COOH (pKa1=6.38,pKa2=10.33)
甲酸:HCOOH(pKa=3.75)
乙酸:CH3COOH(pKa=4.74)
苯甲酸:C6H5COOH(pKa=4.20)
(羧酸pKa数据取自《基础有机化学》第四版邢其毅著)
三、酸性的强弱
在几种酸中:
1、碳酸(HO-COOH):-OH是给电子基,表现为给电子的诱导效应,使HO-C-O-H中的O-H键的极性减弱,导致-COOH的酸性减弱(碳酸的酸性弱于羧酸);
2、几种羧酸同系物中:H原子和CH3-、CH3CH2-等烷基均表现为给电子的诱导效应,且作用依次增强,同样使-COOH中的O-H键的极性减弱,而使羧酸的酸性依次减弱。
3、苯甲酸的结构中含有苯基(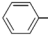 )。
)。
作为烃基之一,苯基同样表现给电子诱导效应,而应该使-COOH的酸性增强;
同时,苯基的大Π键与相连的-COOH中的C(sp2杂化)原子之间产生了Π-Π吸电子共轭效应,使O-H键的极性减弱,而使苯甲酸的极性减弱。
综合诱导效应和共轭效应的共同结果,诱导效应大于共轭效应,最终结果是,导致苯甲酸酸性减弱,弱于甲酸。
总的来说,氢只有给电子的诱导效应,苯环有给电子的诱导效应和吸电子的共轭效应,表现为诱导效应略强于共轭效应,甲基有更强的给电子的诱导效应。因此,苯甲酸和乙酸的酸性都要比甲酸弱;而羟基的给电子能力更强于烃基(此处强于烷基),酸性更弱。
故在考虑诱导效应和共扼效应的综合效应上,应是:
酸性:甲酸>苯甲酸>乙酸>碳酸。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...