
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.整体分析-通读试题,弄清流程目的,大体明确步骤
阅读试题时,切勿急于解答题中的设问(某些通用问题除外),要按“单主线法”的顺序,仔细认真地通读试题,从宏观上整体把握试题难度和考点,初步了解原料、目的和提供的一些课本上没有但题目中必须要用到的新信息。同时养成良好做题习惯,阅读时随手标记目的及相关信息。
简单阅读后,应当深层次的提取流程图中的双主线(如黑白图所示):一是反应线,即物质之间的转化关系(此处考虑复分解及氧化还原);二是操作线,即物质移动时所需的化学实验操作。此时,要千万注意:不要被极个别看不懂的细小环节蒙蔽双眼,此时尚且不必将每个环节的原理都搞清楚,也不必将每个物质都一推出。对于成绩好的同学可以将常见考查形式整理出来,看到题干的设问,来预测可能的问题,做到未卜先知。
1.三线法分析:
转化线:元素守恒—焙烧、溶浸、沉淀、煅烧、电解、结晶等;
除杂线:复分解沉淀、置换沉淀、氧化还原沉淀;加热产生气体等;
分离线:蒸发、结晶、过滤(趁热过滤)、洗涤、干燥等。
2.双线法分析:
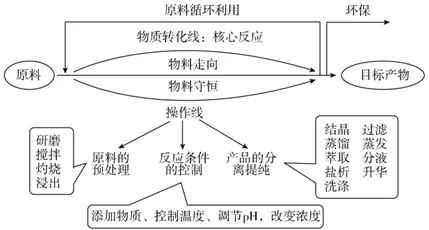
3.主线法分析:
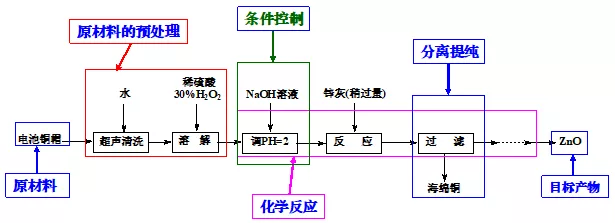
(1)流程图一般三大部分(彩图):原料预处理、核心化学反应、分离提纯。
(2)流程中要分析“进”、“出” 物质和仍然留在溶液中的离子等(否则可能漏掉副产品或干扰离子)。
(3)一般默认进的物质过量,确保每一步目标元素利用率或转化率最高,产品产率最高,减少损失。
二.识别流程
(1)呈现模式
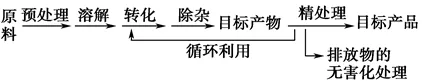
(2)识图方法
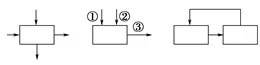
图1 图2 图3
图1箭头表示反应物加入同时生成物出来;
图2箭头表示反应物分步加入和生成物出来;
图3箭头表示循环反应。
三.局部分析—抓住关键,找准命题角度,做到步步为营
通过整体分析,弄清化学工艺流程图的主要目的之后,要按题设中的问题要求,再次回头仔细分析、研究化学工艺流程中与问题相关的局部过程,有针对性地解决题设中提出的每一个问题。此时,针对一些生涩的“化工术语”,可能会阻碍对试题的有效解读,应该进行针对性的讲解、步骤性强的思维训练,明确快速有效的解题策略,哪些术语是不可或缺的哪些是迷惑眼球的。
(1)两个明确
①明确干扰设置的规律:对于陌生的干扰因素,通常是为了使整个化学工艺流程结构完整而设置的,在题设的问题中没有涉及或者不影响答题,此时可以跳过,跟着流程往下一步看,关注的重点应是其产物,对于陌生因素可以看前后流程的信息来大胆猜测。
②明确以问题为导向的分析:工艺流程题设中的问题顺序通常与流程图的流程顺序是一致的,且一个问题对应流程图的一个或依次相连的若干个环节,做题时只需找到所需回答的问题与流程图中相关信息的一一对应关系,“顺藤摸瓜”就可以有效解决相关问题。
(2)抓住关键,找准角度
①抓住关键词,流程图或题干中的关键词是分析和解决问题的直接证据。
预处理阶段-研磨(或粉碎)、灼烧(或焙烧、煅烧)、浸出(水浸、酸浸、碱洗)、搅拌,
核心反应阶段-氧化(或还原)、除杂(加入(或多或正好)沉淀剂、调控溶液的pH或范围控制反应温度、加入保护气),分离提纯阶段—结晶与过滤、洗涤与干燥、脱水(的各种不同方法),后续阶段—滴定计算,转化率计算,产率计算,质量分数计算。
②找准角度,分析设问的角度对功底要求高,此时如果找准角度,就可以轻松的获得信息,明确答题方向。
基本理论(氧化还原反应、化学平衡、盐类水解、电化学)
控制反应条件(温度、催化剂、压强、原料配比、调节溶液的pH、选择溶剂、除杂、产品分离)
绿色化学(循环操作、环境保护、原子经济)
经济角度(原料的利用率高、提高产物的产率或产量、降低能耗)
安全生产(防止污染、爆炸、中毒等)。
四.落笔成句—构建模型,规范答题,获得最大收益
流程的最终目的就是收益最大化,解决流程题同理,在分析完问题后,如何正确的书写是得分的关键,此时针对性的“技巧”“套路”“模板”就必须拿出来了。
(1)获得收益最大化
工艺流程和其他问题不同,它的前后设问经常关联不大,前一问未作答,往往不会影响后面问题的作答。因此,在解答时,不会解答的问题要战略性的放弃,先把能得到的分数得到,对于之前未解决的问题,回过头来还是带着问题看信息来寻找答案。考试的时候,以得分为第一任务。
(2)大量训练,构建模型
①想到答案不要急于书写,要思考:答题角度,信息储备,建立模型
②积累各类实验操作的固定答题模式,明确答题的规矩和规则;
③注重文字、化学用语表达的准确性、严密性、科学性,力求做到答案层次分明,因果清晰。
五.见微知著-明知错误,提前预警,避免低级失误
①答非所问-审题不清,抓不住关键字词句,过滤掉关键答题要求,甚至指鹿为马;
②不遵守学科规范-不用化学原理分析,语言描述太随意,不会使用学科语言;
③基本功欠缺-乱用化学用语表述,书写极为不规范;
④答题毛糙-丢三落四,比如容量瓶不指明规格,物理量漏写计量单位,电子式遗漏孤对电子,方程式未配平、漏写反应条件、沉淀气体符号等。
六.典型流程题
【2020新课标Ⅰ】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是________________________________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成,同时还有___________离子被氧化。写出VO+转化为反应的离子方程式_________________________。
(3)“中和沉淀”中,钒水解并沉淀为,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的_________________________。
(4)“沉淀转溶”中,转化为钒酸盐溶解。滤渣③的主要成分是__________________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是_________________________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是_________________________。
【答案】(1)加快酸浸和氧化反应速率(促进氧化完全)
(2)Fe2+VO++MnO2+2H+=VO2++Mn2++H2O
(3)Mn2+、Al3+和Fe3+
(4)Fe(OH)3
(5)NaAl(OH)4+HCl= Al(OH)3↓+NaCl+H2O
(6)利用同离子效应,促进NH4VO3尽可能析出完全
【分析】黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4,用30%H2SO4和MnO2“酸浸氧化”时VO+和VO2+被氧化成VO2+,Fe3O4与硫酸反应生成的Fe2+被氧化成Fe3+,SiO2此过程中不反应,滤液①中含有VO2+、K+、Mg2+、Al3+、Fe3+、Mn2+、SO42-;滤液①中加入NaOH调节pH=3.0~3.1,钒水解并沉淀为V2O5·xH2O,根据表中提供的溶液中金属离子开始沉淀和完全沉淀的pH,此过程中Fe3+部分转化为Fe(OH)3沉淀,部分Al3+转化为Al(OH)3沉淀,滤液②中含有K+、Na+、Mg2+、Al3+、Fe3+、Mn2+、SO42-,滤饼②中含V2O5·xH2O、Fe(OH)3、Al(OH)3,滤饼②中加入NaOH使pH>13,V2O5·xH2O转化为钒酸盐溶解,Al(OH)3转化为NaAlO2,则滤渣③的主要成分为Fe(OH)3;滤液③中含钒酸盐、偏铝酸钠,加入HCl调pH=8.5,NaAlO2转化为Al(OH)3沉淀而除去;最后向滤液④中加入NH4Cl“沉钒”得到NH4VO3。
【解析】(1)“酸浸氧化”需要加热,其原因是:升高温度,加快酸浸和氧化反应速率(促进氧化完全),故答案为:加快酸浸和氧化反应速率(促进氧化完全);
(2)“酸浸氧化”中,钒矿粉中的Fe3O4与硫酸反应生成FeSO4、Fe2(SO4)3和水,MnO2具有氧化性,Fe2+具有还原性,则VO+和VO2+被氧化成VO2+的同时还有Fe2+被氧化,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;VO+转化为VO2+时,钒元素的化合价由+3价升至+5价,1mol VO+失去2mol 电子,MnO2被还原为Mn2+,Mn元素的化合价由+4价降至+2价,1mol MnO2得到2mol 电子,根据得失电子守恒、原子守恒和电荷守恒,VO+转化为VO2+反应的离子方程式为VO++MnO2+2H+= VO2++Mn2++H2O,故答案为:Fe2+,VO++MnO2+2H+= VO2++Mn2++H2O;
(3)根据分析,“中和沉淀”中,钒水解并沉淀为V2O5·xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、Mn2+,以及部分的Fe3+、Al3+,故答案为:Mn2+,Fe3+、Al3+;
(4)根据分析,滤渣③的主要成分是Fe(OH)3,故答案为:Fe(OH)3;
(5)“调pH”中有沉淀生成,是NaAlO2与HCl反应生成Al(OH)3沉淀,生成沉淀反应的化学方程式是NaAlO2+HCl+H2O=NaCl+Al(OH)3↓或Na[Al(OH)4]+HCl= NaCl+Al(OH)3↓+H2O,故答案为:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓或Na[Al(OH)4]+HCl= NaCl+Al(OH)3↓+H2O。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是:增大NH4+离子浓度,利用同离子效应,促进NH4VO3尽可能析出完全,故答案为:利用同离子效应,促进NH4VO3尽可能析出完全。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在高考化学的工艺流程题中,萃取与反萃取是一对相辅相成、用...
第一种——酸浸 1 、定义: 是指是用无机酸的水溶液作浸出剂的...
在高考化学的工艺流程题中,“浸...
煅烧: 是天然化合物或人造化合物的热离解或晶形转变过程;此...
...
一、钒及其化合物 VB族元素钒(3d 3 4s 2 )的存在形式变化很多。...