
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、商余法
这种方法主要是应用于解答有机物(尤其是烃类)知道分子量后求出其分子式的一类题目。对于烃类,由于烷烃通式为CnH2n+2,分子量为14n+2,对应的烷烃基通式为CnH2n+1,分子量为14n+1,烯烃及环烷烃通式为CnH2n,分子量为14n,对应的烃基通式为CnH2n-1,分子量为14n-1,炔烃及二烯烃通式为CnH2n-2,分子量为14n-2,对应的烃基通式为CnH2n-3,分子量为14N-3,所以可以将已知有机物的分子量减去含氧官能团的式量后,差值除以14(烃类直接除14),则最大的商为含碳的原子数(即n值),余数代入上述分子量通式,符合的就是其所属的类别。
例1:某直链一元醇14克能与金属钠完全反应,生成0.2克氢气,则此醇的同分异构体数目为( )
A.6个 B.7个 C.8个 D.9个
【解析】:由于一元醇只含一个-OH,每mol醇只能转换出1/2mol H2,由生成0.2克H2推断出14克醇应有0.2mol,所以其摩尔质量为72克/摩,分子量为72,扣除羟基式量17后,剩余55,除以14,最大商为3,余为13,不合理,应取商为4,余为-1,代入分子量通式,应为4个碳的烯烃基或环烷基,结合“直链”,从而推断其同分异构体数目为6个。
2、平均值法
这种方法最适合定性地求解混合物的组成,即只求出混合物的可能成分,不用考虑各组分的含量.根据混合物中各个物理量(例如密度,体积,摩尔质量,物质的量浓度,质量分数等)的定义式或结合题目所给条件,可以求出混合物某个物理量的平均值,而这个平均值必须介于组成混合物的各成分的同一物理量数值之间,换言之,混合物的两个成分中的这个物理量肯定一个比平均值大,一个比平均值小,才能符合要求,从而可判断出混合物的可能组成。
例2:将两种金属单质混合物13g,加到足量稀硫酸中,共放出标准状况下气体11.2L,这两种金属可能是( )
A.Zn和Fe B. Al和Zn C. Al和Mg D. Mg和Cu
【解析】:将混合物当作一种金属来看,因为是足量稀硫酸,13克金属全部反应生成的11.2L(0.5摩尔)气体全部是氢气,也就是说,这种金属每放出1摩尔氢气需26克,如果全部是+2价的金属,其平均原子量为26,则组成混合物的+2价金属,其原子量一个大于26,一个小于26,代入选项,在置换出氢气的反应中,显+2价的有Zn,原子量为65,Fe原子量为56,Mg原子量为24,但对于Al,由于在反应中显+3价,要置换出1mol 氢气,只要18克Al便够,可看作+2价时其原子量为27/(3/2)=18,同样假如有+1价的Na参与反应时,将它看作+2价时其原子量为23×2=46,对于Cu,因为它不能置换出H2,所以可看作原子量为无穷大,从而得到A中两种金属原子量均大于26,C中两种金属原子量均小于26,所以A,C都不符合要求,B中Al的原子量比26小,Zn比26大,D中Mg原子量比26小,Cu原子量比26大,故B、D为应选答案。
3、极限法
极限法与平均值法刚好相反,这种方法也适合定性或定量地求解混合物的组成.根据混合物中各个物理量(例如密度,体积,摩尔质量,物质的量浓度,质量分数等)的定义式或结合题目所给条件,将混合物看作是只含其中一种组分A,即其质量分数或气体体积分数为100%(极大)时,另一组分B对应的质量分数或气体体积分数就为0%(极小),可以求出此组分A的某个物理量的值n1,用相同的方法可求出混合物只含B不含A时的同一物理量的值n2,而混合物的这个物理量n(平)是平均值,必须介于组成混合物的各成分A,b的同一物理量数值之间,即n1<n(平)<n2才能符合要求,从而可判断出混合物的可能组成。
例3:4个同学同时分析一个由KCl和KBr组成的混合物,他们各取2.00克样品配成水溶液,加入足够HNO3后再加入适量AgNO3溶液,待沉淀完全后过滤得到干燥的卤化银沉淀的质量如下列四个选项所示,其中数据合理的是( )
A.3.06g B.3.36g C.3.66Gd.3.96
【解析】:本题如按通常解法,混合物中含KCl和KBr,可以有无限多种组合形式,则求出的数据也有多种可能性,要验证数据是否合理,必须将四个选项代入,看是否有解,也就相当于做四道计算题,耗时耗力。使用极限法,设2.00g 全部为KCl,根据KCl-AgCl,每74.5g KCl可生成143.5g AgCl,则可得沉淀为2.00/74.5×143.5=3.852g,为最大值;同样可求得当混合物全部为KBr时,每119g KBr可得沉淀188g,所以应得沉淀为2.00/119×188=3.160g,为最小值。因此答案应介于最大值和最小值之间,答案选BC。
4、估算法
化学题尤其是选择题中所涉及的计算,所要考查的是化学知识,而不是运算技能,所以当中的计算的量应当是较小的,通常都不需计出确切值,可结合题目中的条件对运算结果的数值进行估计,符合要求的便可选取。
例4:已知某盐在不同温度下的溶解度如下表,若把质量分数为22%的该盐溶液由50℃逐渐冷却,则开始析出晶体的温度范围是( )
| 温度(℃) | 0 | 10 | 20 | 30 | 40 |
| 溶解度(克/100克水) | 12 | 15 | 19 | 24 | 38 |
A.0-10℃ B.10-20℃ C.20-30℃ D.30-40℃
【解析】:本题考查的是溶液结晶与溶质溶解度及溶液饱和度的关系.溶液析出晶体,意味着溶液的浓度超出了当前温度下其饱和溶液的浓度,根据溶解度的定义,[溶解度/(溶解度+100克水)]×100%=饱和溶液的质量分数,如果将各个温度下的溶解度数值代入,比较其饱和溶液质量分数与22%的大小,可得出结果,但运算量太大,不符合选择题的特点.从表上可知,该盐溶解度随温度上升而增大,可以反过来将22%的溶液当成某温度时的饱和溶液,只要温度低于该温度,就会析出晶体.代入[溶解度/(溶解度+100克水)]×100%=22%,可得:溶解度×78=100×22,即溶解度=2200/78,除法运算麻烦,运用估算,应介于25与30之间,此溶解度只能在30-40℃中,故选D。
5、差量法
对于在反应过程中有涉及物质的量,浓度,微粒个数,体积,质量等差量变化的一个具体的反应,运用差量变化的数值有助于快捷准确地建立定量关系,从而排除干扰,迅速解题,甚至于一些因条件不足而无法解决的题目也迎刃而解。
例5:在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是( )
A.n×100% B.(n/2)×100% C.(n-1)×100% D.n%
【解析】:根据电离度的概念,只需求出已电离的HA的物质的量,然后将这个值与HA的总量(1升×c摩/升=c摩)相除,其百分数就是HA的电离度.要求已电离的HA的物质的量,可根据HA=H++A-,由于原有弱酸为1升×c摩/升=c摩,设电离度为x,则电离出的HA的物质的量为xc摩,即电离出的H+和A-也分别为cxmol,溶液中未电离的HA就为(c-cx)mol,所以HA、H+、A-的物质的量之和为[(c-cx)+cx+cx]摩,即(c+cx)摩=nc摩,从而可得出1+x=n,所以x的值为n-1,取百分数故选C。
本题中涉及的微粒数较易混淆,采用差量法有助于迅速解题:根据Ha的电离式,每一个Ha电离后生成一个H+和一个A-,即微粒数增大,现在微粒数由原来的c摩变为nc摩,增大了(n-1)×c摩,立即可知有(n-1)×c摩HA发生电离,则电离度为(n-1)c摩/c摩=n-1,更快地选出C项答案。
6、代入法
将所有选项可某个特殊物质逐一代入原题来求出正确结果,这原本是解选择题中最无奈时才采用的方法,但只要恰当地结合题目所给条件,缩窄要代入的范围,也可以运用代入的方法迅速解题。
例6:某种烷烃11克完全燃烧,需标准状况下氧气28L,这种烷烃的分子式是( )
A.C5H12 B.C4H10 C.C3H8 D.C2H6
【解析】:因为是烷烃,组成为CnH2n+2,分子量为14n+2,即每14n+2克烃完全燃烧生成n(摩)CO2和(n+1)摩H2O,便要耗去n+(n+1)/2即3n/2+1/2摩O2,现有烷烃11克,氧气为28/22.4=5/4摩,其比值为44:5,将选项中的四个n值代入(14n+2):[3n/2+1/2],不需解方程便可迅速得知n=3。
7、关系式法
对于多步反应,可根据各种的关系(主要是化学方程式,守恒等),列出对应的关系式,快速地在要求的物质的数量与题目给出物质的数量之间建立定量关系,从而免除了涉及中间过程的大量运算,不但节约了运算时间,还避免了运算出错对计算结果的影响,是最经常使用的方法之一。
例7:一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,求加入的铁粉质量为( )
A.14g B.42g C.56g D.28g
【解析】:由于题目中无指明铁粉的量,所以铁粉可能是过量,也可能不足,则与硫粉反应后,加入过量盐酸是生成的气体就有多种可能:或者只有H2S(铁全部转化为FeCl2),或者既有H2S又有H2(铁除了生成FeCl2外还有剩余),所以只凭硫粉质量和生成水的质量,不易建立方程求解。根据各步反应的定量关系,列出关系式:(1)Fe ~ FeS(铁守恒)~ H2S(硫守恒)~ H2O(氢守恒),(2)Fe~H2(化学方程式)~H2O(氢守恒),从而得知,无论铁参与了哪一个反应,每一个铁原子最终生成了1个水分子,所以迅速得出铁的物质的量就是水的物质的量,与流没有关系所以应有铁粉9/18=0.5mol,即28g。
8、比较法
已知一个有机物的分子式,根据题目的要求去计算相关的量例如同分异构体,反应物或生成物的结构,反应方程式的系数比等,经常要用到结构比较法,其关键是要对有机物的结构特点了解透彻,将相关的官能团的位置,性质熟练掌握,代入对应的条件中进行确定。
例8:分子式为C12H12的烃,结构式为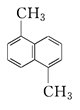 ,若萘环上的二溴代物有9种 CH3 同分异构体,则萘环上四溴代物的同分异构体数目有( )
,若萘环上的二溴代物有9种 CH3 同分异构体,则萘环上四溴代物的同分异构体数目有( )
A.9种 B.10种 C.11种 D.12种
【解析】:本题是求萘环上四溴代物的同分异构体数目,不需考虑官能团异构和碳链异构,只求官能团的位置异构,如按通常做法,将四个溴原子逐个代入萘环上的氢的位置,便可数出同分异构体的数目,但由于数量多,结构比较十分困难,很易错数,漏数.抓住题目所给条件:二溴代物有9种,分析所给有机物结构,不难看出,萘环上只有六个氢原子可以被溴取代,也就是说,每取代四个氢原子,就肯定剩下两个氢原子未取代,根据“二溴代物有9种”这一提示,即萘环上只取两个氢原子的不同组合有9种,即意味着取四个氢原子进行取代的不同组合就有9种,所以根本不需逐个代,迅速推知萘环上四溴代物的同分异构体就有9种。
9、残基法
这是求解有机物分子结构简式或结构式中最常用的方法.一个有机物的分子式算出后,可以有很多种不同的结构,要最后确定其结构,可先将已知的官能团包括烃基的式量或所含原子数扣除,剩下的式量或原子数就是属于残余的基团,再讨论其可能构成便快捷得多。
例9:某有机物5.6克完全燃烧后生成6.72L(S.T.P下)二氧化碳和3.6克水,该有机物的蒸气对一氧化碳的相对密度是2,试求该有机物的分子式.如果该有机物能使溴水褪色,并且此有机物和新制的氢氧化铜混合后加热产生红色沉淀,试推断该有机物的结构简式。
【解析】:因为该有机物的蒸气对一氧化碳的相对密度为2,所以其分子量是CO的2倍,即56,而5.6克有机物就是0.1摩,完全燃烧生成6.72L(S.T.P)CO2为0.3摩,3.6克水为0.2摩,故分子式中含3个碳,4个氢,则每摩分子中含氧为56-3×12-4×1=16克,分子式中只有1个氧,从而确定分子式是C3H4O.根据该有机物能发生斐林反应,证明其中有-CHO,从C3H4O中扣除-CHO,残基为-C2H3,能使溴水褪色,则有不饱和键,按其组成,只可能为-CH=CH2,所以该有机物结构就为H2C=CH-CHO。
10、守恒法
物质在参加反应时,化合价升降的总数,反应物和生成物的总质量,各物质中所含的每一种原子的总数,各种微粒所带的电荷总和等等,都必须守恒.所以守恒是解计算题时建立等量关系的依据,守恒法往往穿插在其它方法中同时使用,是各种解题方法的基础,利用守恒法可以很快建立等量关系,达到速算效果。
例10:已知某强氧化剂[RO(OH)2]+能被硫酸钠还原到较低价态,如果还原含 2.4×10-3mol[RO(OH)2]+的溶液到低价态,需12mL0·2mol/L 的亚硫酸钠溶液,那么R元素的最终价态为 ( )
A.+3 B.+2 C.+1 D.-1
【解析】:因为在[RO(OH)2]+中,R的化合价为+3价,它被亚硫酸钠还原的同时,亚硫酸钠被氧化只能得硫酸钠,硫的化合价升高了2价,根据2.4×10-3mol[RO(OH)2]+与12mL×0.2mol/L=0.0024mol 的亚硫酸钠完全反应,亚硫酸钠共升0.0024×2=0.0048价,则依照升降价守恒,2.4×10-3mol[RO(OH)2]+共降也是0.0048价,所以每mol[RO(OH)2]+降了2价,R原为+3价,必须降为+1价,故不需配平方程式可直接选C。
11、规律法
化学反应过程中各物质的物理量往往是符合一定的数量关系的,这些数量关系就是通常所说的反应规律,表现为通式或公式,包括有机物分子通式,燃烧耗氧通式,化学反应通式,化学方程式,各物理量定义式,各物理量相互转化关系式等,甚至于从实践中自己总结的通式也可充分利用.熟练利用各种通式和公式,可大幅度减低运算时间和运算量,达到事半功倍的效果。
例11:1200℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是 ( )
A.1 B.2 C.3 D.4
【解析】:本题是有机物燃烧规律应用的典型,由于烃的类别不确定,氧是否过量又未知,如果单纯将含碳由1至4的各种烃的分子式代入燃烧方程,运算量大而且未必将所有可能性都找得出.应用有机物的燃烧通式,设该烃为 CxHy,其完全燃烧方程式为: CxHy+(x+y/4)O2==xCO2+y/2H2O,因为反应前后温度都是1200℃,所以H2O为气态,要计体积,在相同状况下气体的体积比就相当于摩尔比,则无论O2是否过量,每1体积CHy只与x+y/4体积O2反应,生成x体积CO2和y/2体积水蒸气,体积变量肯定为1-y/4,只与分子式中氢原子数量有关.按题意,由于反应前后体积不变,即1-y/4=0,立刻得到分子式为CxH4,此时再将四个选项中的碳原子数目代入,CH4为甲烷,C2H4为乙烯,C3H4为丙炔,只有C4H4不可能。
12、排除法
选择型计算题最主要的特点是,四个选项中肯定有正确答案,只要将不正确的答案剔除,剩余的便是应选答案.利用这一点,针对数据的特殊性,可运用将不可能的数据排除的方法,不直接求解而得到正确选项,尤其是单选题,这一方法更加有效。
例12:取相同体积的KI,Na2S,FeBr2三种溶液,分别通入氯气,反应都完全时,三种溶液所消耗氯气的体积(在同温同压下)相同,则KI,Na2S,FeBr2三种溶液的摩尔浓度之比是( )
A.1:1:2 B.1:2:3 C.6:3:2 D.2:1:3
【解析】:本题当然可用将氯气与各物质反应的关系式写出,按照氯气用量相等得到各物质摩尔数,从而求出其浓度之比的方法来解,但要进行一定量的运算,没有充分利用选择题的特殊性.根据四个选项中KI和FeBr2的比例或Na2S和FeBr2的比例均不相同这一特点,只要求出其中一个比值,已经可得出正确选项.因KI与Cl2反应产物为I2,即两反应物mol比为2:1,FeBr2与Cl2反应产物为Fe3+和Br2,即两反应物mol比为2:3,可化简为2/3:1,当Cl2用量相同时,则KI与FeBr2之比为2:(2/3)即3:1,A,B,D中比例不符合,予以排除,只有C为应选项.如果取Na2S与FeBr2来算,同理也可得出相同结果.本题还可进一步加快解题速度,抓住KI,Na2S,FeBr2三者结构特点--等量物质与Cl2反应时,FeBr2需耗最多Cl2。换言之,当Cl2的量相等时,参与反应的FeBr2的量最少,所以等体积的溶液中,其浓度最小,在四个选项中,也只有C符合要求。
13、十字交叉法
十字交叉法是专门用来计算溶液浓缩及稀释,混合气体的平均组成,混合溶液中某种离子浓度,混合物中某种成分的质量分数等的一种常用方法,其使用方法为:组分A的物理量a 差量c-b 平均物理量c(质量,浓度,体积,质量分数等) 组分B的物理量b 差量a-c 则混合物中所含A和B的比值为(c-b):(a-c),至于浓缩,可看作是原溶液A中减少了质量分数为0%的水B,而稀释则是增加了质量分数为100%的溶质B,得到质量分数为C的溶液。
例13:有a克15%的NaNO3溶液,欲使其质量分数变为30%,可采用的方法是( )
A.蒸发溶剂的1/2 B.蒸发掉a/2克的溶剂 C.加入3a/14克NaNO3 D.加入3a/20克NaNO3
【解析】:根据十字交叉法,溶液由15%变为30%差量为15%,增大溶液质量分数可有两个方法:(1)加入溶质,要使100%的NaNO3变为30%,差量为70%,所以加入的质量与原溶液质量之比为15:70,即要3a/14克。(2)蒸发减少溶剂,要使0%的溶剂变为30%,差量为30%,所以蒸发的溶剂的质量与原溶液质量之比为15%:30%,即要蒸发a/2克.如果设未知数来求解本题,需要做两次计算题,则所花时间要多得多。
14、拆分法
将题目所提供的数值或物质的结构,化学式进行适当分拆,成为相互关联的几个部分,可以便于建立等量关系或进行比较,将运算简化.这种方法最适用于有机物的结构比较(与残基法相似),同一物质参与多种反应,以及关于化学平衡或讨论型的计算题。
例14:将各为0.3214摩的下列各物质在相同条件下完全燃烧,消耗氧气的体积最少的是( )
A.甲酸 B.甲醛 C.乙醛 D.甲酸甲酯
【解析】:这是关于有机物的燃烧耗氧量的计算,因为是等摩尔的物质,完全可用燃烧通式求出每一个选项耗氧的摩尔数,但本题只需要定量比较各个物质耗氧量的多少,不用求出确切值,故此题可应用拆分法:甲酸结构简式为HCOOH,可拆为H2O+CO,燃烧时只有CO耗氧,甲醛结构简式HHO,可拆为H2O+C,比甲酸少了一个O,则等摩尔燃烧过程中生成相同数量的H2O和CO2时,耗多一个O,耗氧量必定大于甲酸,甲酸甲酯HCOOCH3拆为2H2O+C2,比乙酸少了H2,耗氧量必定少,所以可知等量物质燃烧时乙醛耗氧最多。
例15:有一块铁铝合金,溶于足量盐酸中,再用足量KOH溶液处理,将产生的沉淀过滤,洗涤,干燥。灼烧使之完全变成红色粉末,经称量,发现该红色粉末和原合金质量恰好相等,则合金中铝的含量为( )
A.70% B.52.4% C.47.6% D.30%
【解析】:本题是求混合金属的组成,只有一个“红色粉末与原合金质量相等”的条件,用普通方法不能迅速解题.根据化学方程式,因为铝经两步处理后已在过滤时除去,可用铁守恒建立关系式:Fe~FeCl2~Fe(OH) 2~Fe(OH)3~(1/2)Fe2O3,再由质量相等的条件,得合金中铝+铁的质量=氧化铁的质量=铁+氧的质量,从而可知,铝的含量相当于氧化铁中氧的含量,根据质量分数的公式,可求出其含量为:[(3×16)/(2×56+3×16)]×100%=30%.
解题中同时运用了关系式法,公式法,守恒法等. 综上所述,“时间就是分数,效率就是成绩”,要想解题过程迅速准确,必须针对题目的特点,选取最有效的解题方法,甚至是多种方法综合运用,以达到减少运算量,增强运算准确率的效果,从而取得更多的主动权,才能在测试中获取更佳的成绩。
当然,解题方法并不仅局限于以上方法,还有各人从实践中总结出来的各种各样的经验方法,各种方法都有其自身的优点.在众多的方法中,无论使用哪一种,都应该注意以下几点:
一、要抓住题目中的明确提示,例如差值,守恒关系,反应规律,选项的数字特点,结构特点,以及相互关系,并结合通式,化学方程式,定义式,关系式等,确定应选的方法。
二、使用各种解题方法时,一定要将相关的量的关系搞清楚,尤其是差量,守恒,关系式等不要弄错,也不能凭空捏造,以免适得其反,弄巧反拙.
三、扎实的基础知识是各种解题方法的后盾,解题时应在基本概念基本理论入手,在分析题目条件上找方法,一时未能找到巧解方法,先从最基本方法求解,按步就班,再从中发掘速算方法。
四、在解题过程中,往往需要将多种解题方法结合一齐同时运用,以达到最佳效果。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一 元素化合物 1、碳酸钠俗名是纯碱、苏打,显碱性但不是碱,...
一、近五年全国卷I、Ⅱ、Ⅲ选择题考点明细 二、有关化学与传...
选择题属于客观性试题,侧重于“双基”的考查。一般其题设条...
1、向某溶液中加入CCl 4 充分振荡后,CCl 4 层显紫色,证明原溶液...
1、商余法 这种方法主要是应用于解答有机物(尤其是烃类)知道分...
1、向某溶液中加入CCl 4 充分振荡后,CCl 4 层显紫色,证明原溶液...