
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、工艺流程的结构
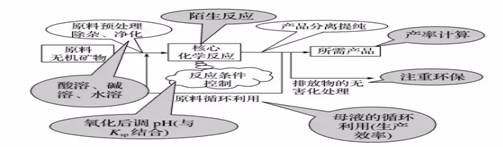
二、必备知识
1.原料的预处理
原料预处理阶段 | 1.研磨、粉碎、 喷洒 | 1.可增大反应物的接触面积和接触机会,加快反应速率,以提高原料转化率、利用率、浸取率,提高产品的产率等目的。 2.增大接触面积:固体--粉碎、研磨; 液体--喷洒; 气体--用多孔分散器等。 |
2.浸出 常用酸浸 | 1.即浸取/溶解:向固体中加入适量溶剂,使其中可溶性的物质溶解或反应进入溶液。 (分为:水浸、酸浸、碱浸、醇浸等)。 固体+水浸等→离子(离子化) 2.水浸:分离水溶性和非水溶性的物质。 +水反应/溶解 3.酸浸:溶解金属/金属氧化物,复分解型 例如:用H2SO4可除Ca2+→CaSO4↓,再用F-(氟化物大多难溶)进一步降低Ca2+的浓度 4.碱浸:除去油污(碱煮)/溶解酸性氧化物/溶解铝及其化合物等。 5.醇浸:提取有机物常采用有机溶剂(乙醚,二氯甲烷等)浸取的方法提取有机物 | |
3.如何提高浸出率 | 1.浸出率:实际浸取量与理论浸取量的比值(S溶解后,离子在溶液中含量的多少) 2.提高浸取率可从反应物接触面积、接触机会、温度、反应物的浓度、溶剂性质等方面思考,适当延长浸出时间、多次浸取等也有助于提高浸出率 | |
4.灼烧、煅烧、焙烧、煅烧 | 1.改变结构,使一些物质能溶解; 2.使一些杂质高温下氧化、分解。 例如:金属(多)硫化物,使S元素→SO2↑(再钙基固硫除) | |
5.搅拌、加热 | 1.加速溶解; 2.增大反应物的接触面积,加快反应速率; 3.对于吸热反应,加热可同时提高原料的转化率,但要避免反应物或生成物的过热分解。 | |
6.增大反应物浓度、加压 | 1.可加快反应速率 2.加压一般是提高气体反应物浓度的措施,不适用:有固体/液体参与的体系 3.生产中常使廉价易得的原料适量过量,以提高另一原料的利用率 | |
7.催化剂 | 1.降低活化能,大大提高反应速率、降低能耗,但不影响化学平衡。 2.必须注意: A.一般需要控温,控pH,防止失活,使反应速率急剧降低 B.防止杂质使催化剂“中毒”,延长使用寿命。 催化剂中毒:反应原料中含有的微量杂质使催化剂的活性、选择性明显下降或丧失的现象 | |
8.表面处理 | 含有很多,如除去表面油污,或金属晶体可用机械发打磨,或化学法除去表面氧化物等。 |
2.控制反应条件
条件的控制 | 1.控pH范围 | 1.目的与答题规范表述: A.分步沉淀:中和/消耗H+/OH-,调节pH,使××生成××沉淀(过滤分离) B.pH过小/过大时,无法生成××,降低××产率/效率 C.(蒸发/结晶前)调节pH××(强酸性),防止/抑制××水解 如调节PH3─4/4─5,Fe3+/Al3+→Fe(OH)3↓、Al(OH)3↓;调节pH7左右,Cu2+→Cu(OH)2↓ 2.方法:+与H+反应,不引入新杂质,所+物质含后除离子/产品中的离子 如除去Cu2+(Fe3+),可加入CuO、Cu(OH)2、Cu2(OH)2CO3等 |
2.控体系的环境氛围 | 1.制备无水晶体:干燥的酸性气流氛围下,抑制水解并带走因分解产生的水汽。 例如:制无水FeCl3:在HCl气体氛围下,蒸发浓缩,冷却结晶 2.还原性氛围:防止××(还原性物质)被氧化。如加入Fe粉防止Fe2+被氧化。 3.加氧化剂氧化。如:+过量H2O2将Fe2+全部氧化为Fe3+ 优点:不引入新杂质,不污染环境 | |
3.控温度 | 1.控高温:加快溶解/反应速率,或促进平衡移动(如促进水解生成沉淀) 2.控低温:防止××在某T会溶解或分解,或促进平衡移动 3.控范围:综合考虑。 ①过低:××速率很慢(溶解/反应) ②过高A.催化剂逐渐失活,υ急剧下降(尤其微生物催化,蛋白质变性) B.反应气溶解度 ,逸出→降低××浸出率/产率 C.××分解(如:H2O2、铵盐、碳酸氢盐等) →×××× D.××挥发(易挥发:醋酸、HCl、液溴、乙醇等)→×××× E.I2升华→×××× ③使反应速率不至于太慢、抑制/促进平衡移动、防止反应物分解、 防止副反应发生、使催化剂的催化活性最高等。 4.方法:A.××浴(水浴、冰水浴、油浴、沙浴) B.缓慢加入××溶液/通入××气体(若为液溴,采用空气吹出法) 5.注意:若给出各物质S信息,则根据S随T的变化情况,采取合适的结晶方法 | |
4.趁热过滤 | 1防止过滤一种晶体或杂质的过程中,因降温而析出另一种晶体。 2.要滤渣(产品):防止降温时析出杂质而影响产品纯度或减少产品溶解损耗(T↑S↓) 要滤液(产品):防止降温时析出产品(T↑S↑)而损耗(除S小或难溶的杂质) 3.方法:将漏斗先置于热水中预热。 | |
5.产品洗涤 | 1.蒸馏水洗涤:除去可溶性杂质 2.冷/冰水洗涤:××××降低产品/晶体的S,减少溶解损耗 3.有机溶剂洗涤:A.减少晶体的溶解损耗B.除去晶体表面水分,便于干燥(适用于易溶于谁的晶体) | |
6煮沸 | 促进水解,聚沉后利于过滤分离;除去溶解在溶液中的气体,如氧气 | |
7.加氧化剂 | 氧化某物质,转化为易于被除去(沉淀)的离子,例如将Fe2+→Fe3+调节pH3-4使水解彻底 | |
8.加氧化物 | 调节pH促进水解(沉淀) | |
循环操作与副产物 | 1.对于可逆反应:可将未转化的反应物分离后送入反应器重新反应。如:合成氨反应,分离氨后的尾气中还含有大量原料气N2和H2可送入合成塔,实施循环生成。 2.若某物质:既是辅助原料又是副产品(既流进又流出),则考虑循环利用。 3.注意:某些隐形存在物质,循环多次后因累积导致浓度过高,影响产品的纯度 |
3.分离提纯与实验操作
常用提纯方法 | 1.水溶法:除可溶杂质 2.酸溶法:除碱性杂质 3.碱溶法:除酸性杂质 4.氧化还原法:除氧化/还原性杂质 5.加热灼烧法:除易分解/易挥发/易升华的杂质 6.调节pH法:如除去H+中Fe3+、Al3+、Cu2+等;除去OH-中SiO32-等 7.沉淀法:除Mn2+Cu2+Ni2+:S2-→金属硫化物↓ | |
常用分离方法 | 1.过滤 | 难溶与易溶特殊:趁热过滤/抽滤(加快过滤速度) |
2.萃取和分液 | 溶质在互不相溶溶剂中S的差异 | |
3.蒸馏或分馏 | 1.互溶液体 2.沸点差异大(20℃以上) | |
4.冷却法 | 气体易液化(NH3、Cl2、SO2)的特点,如合成氨分离出NH3,提高转化率 | |
5.结晶与重结晶 | 固体混合物的分析提纯(重结晶) 1.重结晶:将晶体溶于溶剂,又重新从溶液中结晶的过程。 S→aq→S 2.原理:利用混合物(一般为两种物质混合)中各组分在某溶剂中S不同,或在同一溶剂中(随T变化,S变化不同--通常为:溶质随T↑,S变化大,杂质随T↑,S变化小,杂质可能在溶剂中S大/小)不同T时的S不同而使它们相互分离。 3.从溶液中得到干燥晶体或沉淀的步骤: 若溶质:S大,且T↑,S变化大(一般↑),采用:蒸发浓缩,冷却结晶,过滤、洗涤、干燥 若溶质:S大,且T↑,S变化小,采用:加热浓缩,蒸发结晶,趁热过滤、洗涤、干燥,若杂质:S非常小→→要使杂质在趁热过滤时被滤去留滤纸上: 若溶质:S非常大→→ 过滤/趁热过滤母液中。 4.实例说明:溶质类型 ①NaCl型(KNO3):加热浓缩,蒸发结晶,趁热过滤(留在母液) (S大,且T↑S变化小) ②KNO3型(NaCl):蒸发浓缩(晶膜),冷却结晶,过滤(留在母液)(S大,且T↑S↑) ③苯甲酸的重结晶:蒸发浓缩,趁热过滤,冷却结晶, 过滤(留在滤纸) (杂质S非常小)④Ca(OH)2型:蒸发、结晶 (S小,且T↑S↓) 冷却结晶:适用A.S大且T↑S↑,B.易水解的,C.结晶水合物 | |
实验操作 | 1.洗涤沉淀:往过滤器中加蒸馏水,使水浸没沉淀,待水自然流下后,重复操作2-3次。 目的:去除沉淀表面附着的可溶性的杂质离子和母液 2.检验沉淀是否洗涤干净:取最后一次洗涤液的上清液于试管中,根据沉淀吸附的杂质离子,加入合适的检验试剂 ,若没有特征现象出现,则表明沉淀已洗涤干净。 易溶性晶体洗涤:为减少晶体溶解损失,可用相应的饱和溶液或酒精(有机溶剂)洗涤。 3.滴定终点的判断:当滴入最后一滴标准液时,由××变为××,且30S内不恢复 4.趁热过滤:减少结晶损失;提高纯度 5.干燥(易分解的):低温烘干或自然晾干 6.分液:下层下口放出,上层上口倾出 |
4.核心反应--陌生方程式的书写
箭头:原料--→产品,分清核心元素及杂质元素
核心元素:是否变价,判断核心反应类型氧化还原/非氧化还原具体如下:
①瞻前顾后
瞻前A.看反应物B.条件C.体系酸碱性
顾后A.反应产物(已知+推测)B.注意产物与产物以及产物与体系的酸碱性共存问题
②.分析核心元素化合价
③.与所学同族或相似元素(对角线规则)类比
三、解题策略
原则:复杂问题,分块处理;细节过程,步步推理。
1.读题头,明确目的:找出原料(分析杂质元素)→产品
2.析变价,找核心反应
3.分块拆分:
原料→核心反应一般为:预处理--净化除杂
核心反应→产品一般为:分离提纯
注意:①有时净化除杂也可能在核心反应之后;②核心反应可能不只一步,可为多个。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。煅烧: 是天然化合物或人造化合物的热离解或晶形转变过程;此时化合物受热离解为一种...
...
一、钒及其化合物 VB族元素钒(3d 3 4s 2 )的存在形式变化很多。 一是价态的变化,化合...
...
1.增大原料浸出率(离子在溶液中的含量多少)的措施:搅拌、适当升高温度、延长浸出时...
一、目的(分离提纯、生产制备) 1.使某些金属离子形成氢氧化物沉淀,或防止某些金属离...