
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
物质结构元素周期律
P4 原子序数=核电荷数=质子数=核外电子数
P5 周期表有 18 个纵行,第 8、9、10 三个纵行叫做第 Ⅷ族
3 P5 最外层电子数为 8 的元素,化合价为 0,为 0 族(含最外层电子数为 2 的 He)
4 P5 第 IA族(除氢):碱族元素 第 VIA族:卤族元素 0 族:稀有气体元素
5 P7 碱金属元素除铯外,其余都呈银白色,较柔软,有延展性,碱金属的密度都比 较小,熔点低,导热导电性好
6 P7 液态钠可作为核反应堆的传热介质
7 P8 K、Na 保存在煤油里,Li 保存在石蜡中
8 P8 H2 + F2==2HF 在暗处能剧烈化合并发生爆炸
9 P9 原子结构相似的一族元素,化学性质表现出相似性和递变性
10 P9 原子质量主要集中在原子核上,质子和中子相对质量近似为 1
11 P9 忽略电子质量,将核内所有质子和中子的相对质量取近似整数值相加 ,所得数 值叫做质量数;同种元素原子核中,中子数不一定相同
12 P10 同一元素的不同核素互称为同位素
13 P14 稀有元素的原子半径与相邻非金属元素的数据不具有可比性
14 P16 Mg 与冷水反应缓慢,与沸水反应迅速放出氢气
15 P16 Mg(OH)2 为中强碱,H3PO4 为中强酸
16 P16磷蒸气与氢气能反应
17 P17金属性与非金属性无严格的分界线,分界线附近元素既有一定金属性又有非 金属性
18 P17 元素原子最外层电子层的电子叫做价电子,有些元素的化合价与原子的次外层或倒数第三层的部分电子有关,也叫价电子
19 P18 金属和非金属分界处,可找到半导体材料,如:硅、锗
20 P18 半导体器件研制开始于锗,后到同主族的硅
21 P18 农药由含砷的有机物发展为毒性较低的含磷有机物
22 P18 过渡元素可寻找催化剂,耐高温,耐腐蚀的合金材料
23 P18 人造元素 P19 钫是人工合成的元素
24 P19 钙保存在密封的容器内防氧化
25 P19 锗、锡在空气中不反应,铅在空气表面生成一层氧化铅
26 P19 锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但因生成的 PbCl2 微溶而使 反应终止
27 P19 锗、锡、铅的+4 价氢氧化物碱性顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4
28 P21 O2 不是唯一支持燃烧的物质
29 P21 Na 与 Cl2 反应实验现象描述
30 P23 分子间作用力比化学键弱得多,它对物质的熔沸点有影响
31 P23 NH3、O2、CO2 等气体在降温、增大压强时能够凝结成液态或固态,由于分子 间作用力的影响
32 P24 分子间作用力 <氢键 < 化学键(相互作用强度)
33 P24 水在液态时,除以水分子存在,还含有几个水分子通过氢键形成的( H2O)n
34 P24 固态水(冰)中水分子以氢键结合成排列规整的晶体
35 P24 DNa 的结构和生理活性都与氢键有关
36 P24 氢键使物质熔沸点升高,如:NH3 、H2O 、HF
37 P24 稀有气体不能形成双原子分子
化学反应与能量
1 P32 断开化学键吸收能量,形成化学键释放能量,能量越低物质越稳定
2 P32 煤、石油、天然气的主要化学成分是烃类等有机物
3 P32 高温煅烧石灰石得到生石灰
4 P33 质量守恒定律和能量守恒定律是两条基本的自然定律
5 P34 Ba(OH)2 · 8H2O + 2NH4Cl ==BaCl2 + 2NH3 + 10H2O (复分解、吸热)
6 P34 化学反应伴随着能量变化是化学反应的基本特征之一
7 P35 不同社会发展水平时期的人均耗能量不相同
8 P36 所有的燃烧反应都会释放能量
9 P37 我国目前最主要的能源是煤炭
10 P37 什么是生物质呢?
11 P38 使 1kg 水的温度升高 1℃需热量 4.18KJ
12 P39 一次能源:流水、风力、原煤、石油、天然气、天然铀矿等;二次能源:电力、蒸汽等
13 P39 火电是怎样发电的
14 P42 锌锰干电池即使不用,放置太久,也会失效
15 P43 充电电池的充电次数有限制,使用是否得当,对电池的寿命影响很大
16 P43 新型的封闭式体积小的充电电池——镍镉电池。以 Cd 为负极,NiO(OH)为正极,以 KOH 为电解质。由于镉是致癌物质,制约了镍镉电池的发展
17 P43 锂是最轻的金属,也是活动性极强的金属,是制造电池的理想物质
18 P44 燃料电池是一种高效、环境友好的发电装置。燃料电池的能量转化率理论上可高达 85%-90%
19 P46 化学电池是一种可移动或便携式电源,不足有:电压较低、寿命较短、存放期有限等
20 P48 P49 影响化学反应速率的条件不只是温度和催化剂
21 P50 勒夏特列原理揭秘:C +CO2  2CO 是可逆反应
2CO 是可逆反应
22 P52 提高燃料的燃烧效率的措施
23 P53 一些橡胶或塑料制品中要添加抑制剂(负催化剂,能减缓反应速率)
24 P53 氯酸钾在发生分解反应时会释放出氧气,并生成氯化钾,但反应速率较低
25 P57 为什么实验室常用大理石与稀盐酸反应制取 CO2,不用纯碱与盐酸或硫酸制取CO2
有机化合物
1 P60 甲烷是天然气、沼气、煤油气和煤矿坑道气的主要成分
2 P60 天然气是一种高效、低耗、污染小的清洁能源
3 P61 空气中的甲烷含量在 5%-15.4%范围内时,遇火花发生爆炸
4 P61 家用或工业用天然气中,常掺入少量有特殊气味的杂质气体,以警示气体的 泄露
5 P63 在未特别指明的情况下,相对密度均指 20℃时某物质的密度与 4℃时水的密 度的比值
6 P65 适用于管道煤气的灶具在改为用于天然气时,需将进风口改大
7 P65 在严寒的冬季,管道煤气有时会出现火焰变小或断续现象原因:煤气状态发 生改变
8 P66 从石油中获得乙烯,从石油或煤焦油中还可获得苯
9 P66 乙烯的产量可以用来衡量一个国家的石油化工水平
10 P67 石蜡油分解实验中,碎瓷片的作用是作催化剂,加快石蜡油的分解速率
11 P69为延长果实或花朵的成熟期,又需用浸泡过高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯,以达到保鲜的要求
12 P69 苯是 1825 年由英国科学家法拉第首先发现的
13 P69 苯用冰冷却,可凝成无色晶体
14 P70 四氟乙烯是常见的氟碳化合物,可用于制家用不粘锅的保护膜氟纶
15 P70 氟碳化物还可能成为未来的人造血液
16 P71 蒸馏苯甲酸和石灰的混合物可制的苯
17 P73 可用医用注射针头,收集并验纯气体
18 P74 检验酒后驾车的装置,含有酸性重铬酸钾,遇到乙醇时橙色变为绿色
19 P75 乙醇可与酸性高锰酸钾溶液或酸性重铬酸钾溶液反应,直接氧化成乙酸
20 P75 普通食醋中含有 3%-5%的乙酸
21 P76 用人工合成方法合成的酯,用作饮料、糖果、香水、化妆品中的香料,也可 以用作指甲油、胶水的溶剂
22 P76 可用金属钠、碳酸钠溶液、紫色石蕊溶液区分乙酸、乙醇、苯
23 P79 蛋白质的特征反应:硝酸可以使蛋白质变黄,称为蛋白质的颜色反应
24 P80 葡萄糖是重要的工业原料,主要用于食品加工、医疗输液、合成补钙药物及 维生素 C
25 P81 利用富含纤维素的物质制造纤维素硝酸酯、纤维素乙酸酯和黏胶纤维
26 P81 动物胶可以制造照相用片基,驴皮制的阿胶是一种药材,从牛奶中提取的酪 素,可以用来制作食品和塑料
27 P85 氟利昂-12 是甲烷的氟、氯卤代物,结构简式为 CF2Cl2
28 P85 阿司匹林、去痛片等药片是用淀粉作为黏合材料压制而成的片剂
化学与自然资源的开发利用
1 P88 超分子通常是由两种或两种以上分子依靠分子间作用力结合在一起的具有一定结构和功能的聚合体
2 P88 金属的冶炼:
①对一些不活泼金属,可以直接加热分解
②对一些活泼金属,可以用电解法
3 P89 铝热反应的实验中:氯酸钾为助燃剂及氧化剂的作用,且氧化铁和铝粉按 3:1混合
4 P89 铜的冶炼原理:
①湿法炼铜:CuSO4 + Fe= Cu + FeSO4
②火法炼铜:Cu2S + O2  2Cu + SO2
2Cu + SO2
5 P90 海底多金属结核矿含有铁、锰、钴等金属元素
6 P90 海水的淡化有蒸馏法、电渗析法、离子交换法等
7 P91 证明还带中有碘元素的实验中
8 P91 空气吹出法是海水提溴的常用方法,其中使溴吹入吸收塔,使溴蒸气和 SO2反应生成氢溴酸以达到富集的目的
9 P93 蓝铜矿【2CuCO3 · Cu(OH)2】,与焦炭加热反应
【2CuCO3 · Cu(OH)2】 + 3C 6Cu + 7CO2 +2H2O
6Cu + 7CO2 +2H2O
10 P94 孔雀石主要成分为 CuCO3 · Cu(OH)2,金红石主要成分是 TiO2
TiO2 + 2 C +2Cl2  TiCl4 + 2 CO
TiCl4 + 2 CO
11 P95 ①煤的干馏:将煤隔绝空气加强热使之分解,也叫煤的焦化
②煤的气化是将其转为可燃性气体:C + H2O(g) CO +H2
CO +H2
③煤的液化是使煤与氢气作用生成液体燃料
12 P101 原子利用率=期望产物的总质量与生成物总质量之比
13 P102 以乙烯为原料生产环氧乙烷
①CH2=CH2 + Cl2 + Ca(OH)2
![]() + CaCl2 + H2O
+ CaCl2 + H2O
②2CH2=CH2 + O2  2
2![]()
14 P103 甲基丙烯酸甲酯的新合成方法
①用刷子刷而不用水洗,目的是防止碘离子( I-)被洗掉
CH3CC H + CO + CH3OH
H + CO + CH3OH CH
CH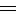 C(CH3 )COOCH
C(CH3 )COOCH
②用酒精润湿,放入坩埚,目的是使还带充分燃烧
③煮沸的目的是使碘离子( I -)充分溶解
④离子方程式: 2I- +IO3-+ 2H+= 3I2+2H2O
15 P105 溶液中 IO3- 和 I -可发生反应:IO3-+5 I-+ 6H+==3I2+3H2O
16 P106 SnCl2 加入过量的 FeCl 3溶液中有:SnCl2+FeCl3 == SnCl4+FeCl2
17 P106 6FeCl2+K2Cr2O7+14HCl ==6FeCl2+2KCl +2CrCl3+7H2O
18 P106 卤块的主要成分是 MgCl2
19 P107 几种氢氧化物沉淀的 pH
氢氧化铁 2.7-3.7 ;氢氧化亚铁 7.6-9.6;氢氧化锰 8.3-9.8 ;氢氧化镁 9.6-11.1
20 P107 腈纶是由 CH2=CH-CN 聚合而成,CH2=CH-CN 可由下列反应制的
2CH3-CH=CH2 + 2NH3 + 3O2  2CH2=CH-CN + 6H2O
2CH2=CH-CN + 6H2O

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在笔者的教学工作中,常常能听到一部分学生反馈自己基础比较差,或者前期未认真学习后...
一、氧化还原反应 (一)回扣要点知识 (二)辨析易混易错问题 判断下列说法是否正确...
1、 掌握一图(原子结构示意图)、五式(分子式、结构式、结构简式、电子式、简式)、六方...
1. 熔化状态下能导电的物质一定是电解质。 不一定,如金属单质(Cu) 2. 熔化状态下不能...
一、原子结构与性质 (1)原子均由质子数、中子数和核外电子组成; 错因分析:特例: 1 ...
高中化学教材中,有一个平衡理论体系,包括 溶解平衡、化学平衡、电离平衡、水解平衡...