
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
“钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金……”说起这个,你肯定很熟悉,这是“金属活动性顺序表”。金属活动性是指金属单质在水溶液中还原性的强弱,一般表现为该元素单质与水(或酸)反应置换出氢的难易程度,其关系可查标准电极电势表查出,亦可由实验定性判定。
[实验一]药品:两颗相同质量的约绿豆粒大的钾、钠金属粒,蒸馏水;器材:两只烧杯,滤纸;步骤:用滤纸吸去钾、钠金属粒表面的煤油,同时投入两个盛有等量蒸馏水的烧杯中。现象:钾与稀盐酸反应比钠更剧烈。结论:钾的活动性比钠强。
同时,我们有“金属性”一词。元素的 “金属性”是指气态中性原子失去电子的性质。元素的金属性可以从该元素最高价氧化物的水化物的碱性的强弱、单质与水或酸反应产生氢气的难易程度等方面来推测。一般地,元素最高价氧化物的水化物的碱性越强,单质与水或酸反应产生氢气的速率越大,它的金属性越强。金属性与金属活动性的大小往往是一致的。钾和钠同属ⅠA族元素,钠的原子序数为十一,钾为十九,钾的原子半径大于钠,其原子核对核外电子的束缚力较钠小,最外层电子也更易失去,所以钾的金属性比钠强。由此可见,钾和钠的金属活动性顺序和金属性强弱顺序一致。
在《元素周期表》中,“锂”和“钾”、“钠”属ⅠA族,为碱金属,锂的原子序数为三,同上可知:锂的金属性比钠弱。那么,锂的金属活动性是否也弱于钠呢?
[实验二]药品:两颗相同质量的约绿豆粒大的钠、锂金属粒,蒸馏水;器材:两只烧杯,滤纸;步骤:用滤纸吸去钠金属粒表面的煤油和锂表面的石蜡,同时投入两个盛有蒸馏水的烧杯中。现象:钠与水反应比锂剧烈。一般地,我们会得出这样的结论:钠的活动性比锂强。但查标准电极电势表(298.15K):E(Li+/Li)=-3.040V,E(Na+/ Na)=-2.714V,与实验不相符,这是为什么呢?
碱金属与水反应的历程为:固态的碱金属变为气态的碱金属,这一过程吸收能量,称为“升华焓”;气态的碱金属原子失去一个电子变为碱金属离子,吸收能量,称为“第一电离能”;气态的碱金属离子进入溶液,形成水合离子,放出热量,称为“水合焓”。以上可用下简图表示:
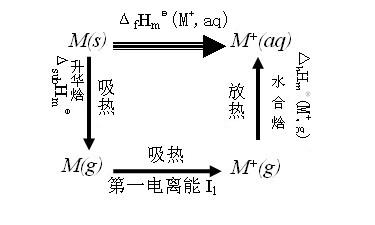
锂的升华焓和第一电离能均大于钠。水合焓正比于离子所带电荷,反比于离子半径,锂离子(Li+)与钠离子(Na+)所带电荷相等,而锂离子半径很小,以至锂的水合热大于钠,使得锂变成锂离子的总过程中放出的能量大于钠。ΔrGmΘ= -TΔrSmΘ,如果不考虑ΔrSm的差异,锂与水反应的Gibbs自由能变小于钠(比钠更负)。ΔrGmΘ=-zEΘF,因此,锂的标准电极电势小于钠,甚至小于铯[E(Cs+/ Cs)=-3.027V]。由于锂的升华焓大,不易活化,且锂的熔点高(180.45℃),反应时不能像钠(97.82℃)一样熔化,与水接触的表面积小,使得锂与水反应较缓慢。且LiOH溶解度(13.0g/100H2O)较小,会覆盖在锂的表面,也使反应速率降低。
在科学的探究过程中,演绎和归纳类比是一个重要的科学思维,但不总是一成不变。我们应该适当地应用“类比”思想预测元素的性质,但不能绝对化,否则会引起科学性错误,必须用实验加以验证,且不能只看到表面现象。只有这样,我们才能得到正确的知识,稳步走进科学的殿堂。
附:
表二 碱金属的一些性质
| Li | Na | K | Rb | Cs |
金属半径/pm | 152 | 186 | 227 | 248 | 265 |
熔点/℃ | 180.54 | 97.82 | 63.38 | 39.31 | 28.44 |
0.98 | 0.93 | 0.82 | 0.82 | 0.79 | |
第一电离能/(KJ·mol‑1) | 526.41 | 502.04 | 425.02 | 409.22 | 381.90 |
表1 计算碱金属ΔfHmΘ(M+,aq)的有关数据
| Li | Na | K | Rb | Cs |
ΔsubHmΘ/(KJ·mol‑1) | 159.37 | 107.32 | 89.24 | 80.88 | 76.065 |
I1/(KJ·mol‑1) | 526.41 | 502.04 | 425.02 | 409.22 | 381.90 |
ΔhHmΘ(M+,g) /(KJ·mol‑1) | -535.27 | -420.48 | -337.64 | -312.27 | -287.24 |
ΔfHmΘ(M+,g) /(KJ·mol‑1) | 150.51 | 188.88 | 176.62 | 177.83 | 170.72 |
E/(M+/M)/V | -3.040 | -2.714 | -2.936 | -2.943 | -3.027. |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
钠(Na)的密度为0.97g/cm,而钾(K)的密度为0.862g/cm。碱金属族...
1943年,彼时的中国正处于对日抗战的艰苦岁月。那一年,中国化...
因为在钾的化合物中往往混有一些钠的化合物(不易分离),在...
在有关原子 —分子概念的争论中,一直注意着理论的发展却从不...
为什么碳酸钠溶于水放热,而碳酸氢钠溶于水却吸热呢? 首先,...
氢几乎能与除稀有气体外的元素结合成二元化合物,这些二元化...