
|
学习小专题 |
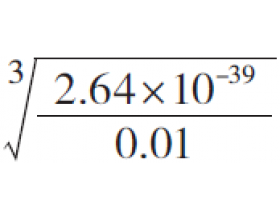 如何求难溶氢氧化物开始沉淀和沉淀完全时的pH ?
日期:2020-07-17 11:13:35
点击:12172
好评:2
如何求难溶氢氧化物开始沉淀和沉淀完全时的pH ?
日期:2020-07-17 11:13:35
点击:12172
好评:2
例9 某溶液中含杂质Fe 3+ 为0.01 mol·L -1 ,已知室温下Fe(OH) 3 的 K sp =2.64×10 -39 ,计算(1)开始生成Fe(OH) 3 沉淀的pH;(2)Fe 3+ 沉淀完全时的pH。(被沉淀离子浓度小于1.0×10 -5 mol·L -1 时, 可以认为已沉淀完全) 解析:开始沉淀和沉淀完全时Fe 3+ ...
 酸性溶液,铁、铜离子怎么会转化为氢氧化物沉淀?
日期:2020-07-17 11:12:11
点击:5465
好评:0
酸性溶液,铁、铜离子怎么会转化为氢氧化物沉淀?
日期:2020-07-17 11:12:11
点击:5465
好评:0
“沉淀溶解平衡原理应用”一小节教材中提到:除去硫酸铜溶液中混有的少量铁离子,可向溶液中加入氢氧化铜或碱式碳酸铜,调节溶液的pH至3-4,铁离子就会全部转化为氢氧化铁沉淀除去。”“当溶液的P H超过5时,铜离子才开始转化为氢氧化铜沉淀。” 许多学生不明白,溶液...
 化学反应中的八大沉淀
日期:2020-04-14 09:40:28
点击:26144
好评:9
化学反应中的八大沉淀
日期:2020-04-14 09:40:28
点击:26144
好评:9
1.在化学变化中,一般来说有八大沉淀: AgCl(氯化银)、BaSO 4 (硫酸钡)、CaCO 3 (碳酸钙)、BaCO 3 (碳酸钡)、Ag 2 CO 3 (碳酸银)、Mg(OH) 2 (氢氧化镁)、Cu(OH) 2 (氢氧化铜)、Fe(OH) 3 (氢氧化铁) 其中,AgCl , BaSO 4 ,CaCO 3 , BaCO 3 , Ag 2 CO 3 (颜色说法不一...
 强烈双水解一定生成氢氧化物吗?
日期:2020-04-14 09:37:54
点击:1601
好评:0
强烈双水解一定生成氢氧化物吗?
日期:2020-04-14 09:37:54
点击:1601
好评:0
本文来自微信公众号:一个芦老师,作者:芦峰 多数学生有一个错误的认知:金属阳离子与弱酸根阴离子发生强烈双水解时,金属阳离子得到氢氧化物,酸根得到对应的弱酸。很多同学还会去死记硬背能够强烈双水解的离子,如: Al 3+ 与C O 3 2 - 在水中生成Al(OH) 3 Al 3+ ...
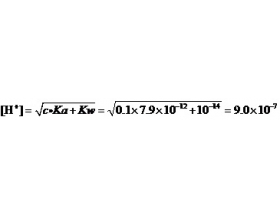 判断金属离子强酸盐溶解时是否有氢氧化物沉淀产生的计算
日期:2020-04-14 09:37:14
点击:1185
好评:0
判断金属离子强酸盐溶解时是否有氢氧化物沉淀产生的计算
日期:2020-04-14 09:37:14
点击:1185
好评:0
对一定浓度的含有某金属离子的溶液来说,判断其中是否有氢氧化物沉淀出现的方法其实是很简单的。因为根据溶度积规则,只要满足条件[M n+ ][OH - ] n ≧ K sp ,溶液中就会有M[OH] n 沉淀生成。 要注意的是,当金属离子有较强的水解趋势时,金属离子的分析浓度 c 并不...
 情景素材:高中化学12大氢氧化物沉淀
日期:2020-04-14 09:29:08
点击:399
好评:0
情景素材:高中化学12大氢氧化物沉淀
日期:2020-04-14 09:29:08
点击:399
好评:0
情景素材:高中化学12大氢氧化物沉淀。...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。