
|
学习小专题 |
 为什么F-F键键能反常的低?
日期:2025-05-29 09:08:02
点击:17402
好评:0
为什么F-F键键能反常的低?
日期:2025-05-29 09:08:02
点击:17402
好评:0
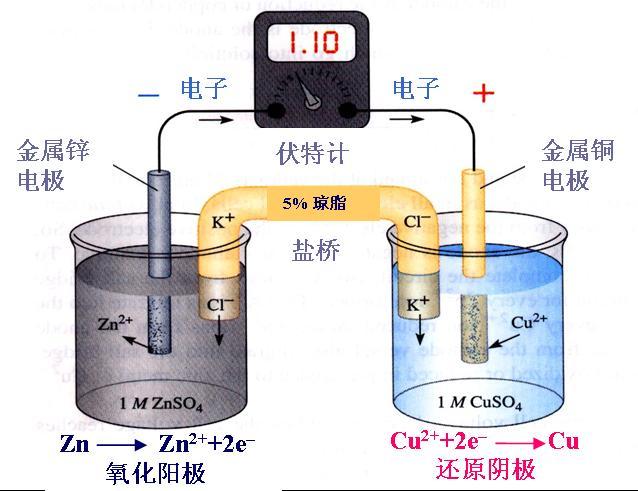
一般来说,同主族元素形成的R-R键键能从上至下,键长逐渐增大,键能逐渐降低。所以选修3有一句话:“键长越短,键能越大”,当然加了个“往往”。 但不管用哪种解释,F-F都出现反常,反常的低。F是VIIA“最上面”的元素,且F-F的键长较短,按理说键能应该较高。 共价键 ...
 实验演示:氟气、氯气与氢气的反应对比
日期:2022-02-23 10:53:49
点击:307
好评:0
实验演示:氟气、氯气与氢气的反应对比
日期:2022-02-23 10:53:49
点击:307
好评:0
...
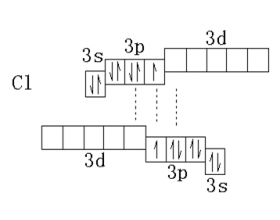 Cl2分子中的Cl-Cl键能为什么比F2中F-F键能高?
日期:2017-04-18 15:46:52
点击:9261
好评:1
Cl2分子中的Cl-Cl键能为什么比F2中F-F键能高?
日期:2017-04-18 15:46:52
点击:9261
好评:1
氯分子中Cl-Cl键的键能是239KJ·mol -1 。为什么Cl-Cl键能比F-F键能大呢?氟位于第二期,而氯位于第三周期,它具有空的3d轨道。当利用这种空的d轨道作为电子对接受体时,就能产生新的化学键。 也就是说在Cl 2 分子中既有靠未成对电子形成的共价键,又有靠孤对电子和空轨...
 卤素单质的制备
日期:2014-12-19 09:17:46
点击:10847
好评:0
卤素单质的制备
日期:2014-12-19 09:17:46
点击:10847
好评:0
1.F 2 的制备 由于F2的氧化性极强,因此欲制备F 2 ,只能用最强的方法电解法,电解质是KF.nHF(熔融)电解时用石墨做阳极,钢或软钢做阴极并做电解槽的材料, 阳极:石墨,2F - -2e===F 2 阴极:钢,2HF2-+2e===H 2 +4F- 95~100C,阴极与阳极用钢网隔开,避免F2和H2...
 情景素材-氟气与金属铯化合反应
日期:2013-10-18 16:02:31
点击:465
好评:0
情景素材-氟气与金属铯化合反应
日期:2013-10-18 16:02:31
点击:465
好评:0
最疯狂而最简单的化合反应,一个在著名的英国贵族研究型学府---莱切斯特大学里的化学实验室里进行的实验。...
 卤族图片集
日期:2012-04-24 21:48:42
点击:510
好评:2
卤族图片集
日期:2012-04-24 21:48:42
点击:510
好评:2
氟单质 氯单质 溴单质 碘单质 砹单质 碘升华 萤石1 萤石2 食盐 食盐晶体 冰晶石 氯气 萤石 聚四氟乙烯 三氟化硼球棍模型 四氟乙烯球棍模型 氟气 氯化银沉淀 钠与氯气反应 氢氟酸 氯化钠晶体结构 盐酸 液氯 氯化氢与氨气化合 氢气与氯气光照爆炸 溴的扩散 溴单质 碘单质 ...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。